题目内容
【题目】观察图中 A、B、C 三个装置,回答下列问题:
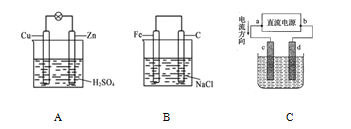
(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,可观察到锌片上有气泡,再平行插入一铜片,可观察到铜片上_________(填“有”或“没有”)气泡产生。用导线把锌片和碳棒连接起来组成一个原电池(图A),正极的反应式为_______。
(2) 如果烧杯中最初装入的是 500 mL 2 mol·L-1 硫酸溶液,构成铜锌原电池,当收集到 11.2 L(标准状况下)H2 时,溶液体积变化忽略不计,则烧杯内溶液中硫酸的物质的量的浓度为_______mol/L。
(3) 如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(图 B),放置数天后,铁片生锈。负极反应式为_______。
(4) 图 C 是电解 CuCl2 溶液的装置,其中 c、d 为石墨电极。
①正极为_______(填“a”或“b”)。
②阳极电极反应式为_______,检验该阳极产物的方法是将_______试纸靠近电极。
③电解一段时间后发现阴极增重 6.4 g,若该电解反应所需的电子全部由氢氧燃料电池提供,则至少需要消耗_______L 氢气(标准状况下)才能满足需要。
【答案】没有 2H++2e-=H2↑ 1mol/L Fe-2e-=Fe2+ a 2Cl--2e-=Cl2 湿润的淀粉碘化钾 2.24L
【解析】
(1)根据原电池的构造和与原理分析;
(2)根据正极反应:2H++2e-=H2↑,当在标准状况下收集到11.2L即0.5mol的氢气时,转移电子是1mol,减少的氢离子为1mol,所以剩余的硫酸的量为0.5mol,负极上的电极反应式为:Zn-2e-=Zn,当转移电子1mol时,生成锌离子的量为0.5mol,结合浓度概念计算;
(3)铁片、石墨和氯化钠溶液构成的原电池中,金属铁发生吸氧腐蚀,铁失电子变为亚铁离子;
(4)①根据图中电流的流向判断正负极,电解池中与负极相连的为阴极,与之间相连的为阳极;
②阳极上氯离子失电子生成氯气;根据氯气的氧化性检验;
③根据铜和转移电子及生成氢气之间的关系式计算。
(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,锌与稀硫酸反应生成氢气,可观察到锌片上有气泡,再平行插入一铜片,铜与稀硫酸不反应,因此铜片上没有气泡产生;用导线把锌片和碳棒连接起来,锌片、铜片和硫酸形成的原电池中,铜片为正极,该极上氢离子得电子生成氢气,电极反应为:2H++2e=H2↑;
(2)根据正极反应:2H++2e=H2↑,当在标准状况下收集到11.2L即0.5mol的氢气时,转移电子是1mol,减少的氢离子为1mol,所以剩余的硫酸的量为0.5mol,其浓度为![]() =1mol/L;
=1mol/L;
(3)铁片、石墨和氯化钠溶液构成的原电池中,金属铁发生吸氧腐蚀,正极上是氧气得电子发生还原反应,负极是铁失电子变为亚铁离子,发生氧化反应,电极反应为:Fe2e=Fe2+;
(4)①由图可知电流从a流向b,则a为电池的正极,b为负极,c与正极相连,所以c为阳极;
②阳极上氯离子失电子生成氯气,其电极反应式为:2Cl2e=C12↑,氯气具有较强的氧化性,与碘化钾反应置换出碘单质,能使湿润的淀粉碘化钾试纸变蓝;
③极上的电极反应为:Cu2++2e=Cu,已知阴极增重6.4g,则n(Cu)=![]() =0.1mol,所以转移的电子为0.2mol,氢氧燃料电池中消耗1mol氢气转移2mol电子,所以转移的电子为0.2mol时,消耗的氢气为0.1mol,则V(H2)=nVm=0.1mol×22.4L/mol=2.24L。
=0.1mol,所以转移的电子为0.2mol,氢氧燃料电池中消耗1mol氢气转移2mol电子,所以转移的电子为0.2mol时,消耗的氢气为0.1mol,则V(H2)=nVm=0.1mol×22.4L/mol=2.24L。

【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度 | 水溶性 |
A | C2H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是( )
A.分馏B.升华C.萃取D.分液