题目内容
【题目】日常生活中食用的白糖、冰糖和红糖的主要成分是( )
A.淀粉
B.葡萄糖
C.蔗糖
D.果糖
【答案】C
【解析】A.淀粉主要存在植物种子和块茎中,最终变为葡萄糖,供机体活动需要,故A不符合题意;
B.葡萄糖主要是放出能量,供机体活动和维持体温恒定的需要,故B不符合题意;
C.因为蔗糖是食品中常用得到甜味剂,故C符合题意;
D.果糖是所有的糖中最甜的一种,广泛用于食品工业,如制糖果、糕点、饮料等,故D不符合题意.
所以答案是:C.

 字词句段篇系列答案
字词句段篇系列答案【题目】某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
实验 | 操作 | 现象 |
I | 常温下将MnO2和12molL-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4molL-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性.I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是______.
②II中发生了分解反应,反应的化学方程式是______.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:
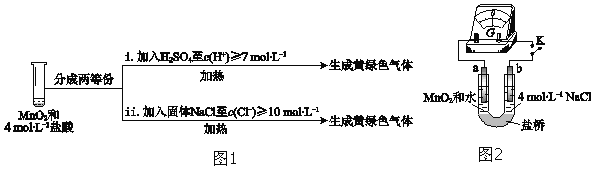
将实验 III、IV作对比,得出的结论是______;将 i、ii作对比,得出的结论是______.
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7molL-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7molL-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是______.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸______(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
实验 | 操作 | 现象 |
I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
III | … | … |
通过实验I、II、III证明混合气体中含有Cl2,III的操作是______.
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、______有关.