题目内容
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。
已知常温下浓盐酸与高锰酸钾能反应生成氯气。
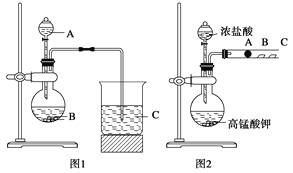
(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)____;
①稀硫酸溶液; ②浓盐酸; ③碳酸钠粉末;④Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式为__________________________________________;
(2)甲同学所做实验图1烧杯中现象为____________________________________;
(3)乙同学所做实验图2中B处的现象为__________________________________;
(4)写出图2中A处发生反应的离子方程式为__________________________________________。
【答案】 ①③ CO32-+2H+=== 2CO2↑+H2O 溶液出现白色沉淀 试纸变蓝 2Br-+Cl2===2Cl-+Br2
【解析】(1)根据甲设计的实验装置图可知,其实验的原理是利用较强酸制较弱酸。图1中试剂A、B为①稀硫酸溶液,③碳酸钠粉末;有关反应的离子方程式:![]() 。
。
(2)因生成硅酸,不溶于水,实验图1烧杯中现象是溶液出现白色沉淀 。
(3)要验证卤族元素性质的递变规律,则可以利用活泼的非金属单质置换较不活泼的非金属单质来实现。酸性高锰酸钾溶液能把盐酸氧化生成氯气,所以B处反应的离子方程式是2I-+Cl2===2Cl-+I2。因生成I2,淀粉KI试纸变蓝。
(4)酸性高锰酸钾溶液能把盐酸氧化生成氯气,所以A处反应的离子方程式是:2Br-+Cl2===2Cl-+Br2。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案