题目内容
室温下,某浓度的醋酸溶液中n(CH3COO-)=0.01mol,下列叙述正确的是
| A.向该醋酸溶液中加入等体积等浓度的盐酸,抑制醋酸的电离,溶液中c(H+)增大 |
| B.若醋酸溶液体积为1L,则c(CH3COOH)=0.01mol/L |
| C.与NaOH恰好中和时,溶液中c(Na+)<c(CH3COO-) |
| D.与等体积等浓度的醋酸钠溶液混合,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-) |
AD
解析试题分析:醋酸是弱酸,盐酸是强酸,前者部分电离,后者完全电离,加入等浓度盐酸,增大溶液中氢离子浓度,使CH3OOH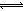 CH3COO—+H+的平衡左移,故A选项正确;由于n(CH3COO-)=0.01mol,说明已经电离的醋酸为0.01mol,则未电离的醋酸远远大于0.01mol,若醋酸溶液体积为1L,则c(CH3COOH)>0.01mol/L,故B选项错误;醋酸与氢氧化钠恰好中和时,溶液中的溶质只有醋酸钠,CH3OONa="=" CH3COO—+Na+,由于钠离子不能水解,醋酸根离子部分水解,则溶液中c(Na+)>c(CH3COO-),故C选项错误;混合溶液呈电中性,含有钠离子、氢离子、氢氧根离子和醋酸根离子,根据电荷守恒原理,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),故D选项正确。
CH3COO—+H+的平衡左移,故A选项正确;由于n(CH3COO-)=0.01mol,说明已经电离的醋酸为0.01mol,则未电离的醋酸远远大于0.01mol,若醋酸溶液体积为1L,则c(CH3COOH)>0.01mol/L,故B选项错误;醋酸与氢氧化钠恰好中和时,溶液中的溶质只有醋酸钠,CH3OONa="=" CH3COO—+Na+,由于钠离子不能水解,醋酸根离子部分水解,则溶液中c(Na+)>c(CH3COO-),故C选项错误;混合溶液呈电中性,含有钠离子、氢离子、氢氧根离子和醋酸根离子,根据电荷守恒原理,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-),故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及醋酸电离平衡的移动、物质的量浓度的计算、盐类水解、盐溶液中离子浓度大小关系、盐溶液中电荷守恒关系式等。

将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是 ( )
| A.c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B.c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C.c(Na+)> c (OH-) > c(CH3COO-) >c(H+) |
| D.c(Na+)> c (OH-) > c(H+)> c(CH3COO-) |
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是
A.由水电离出的c(H+):③>①
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ)
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于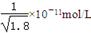 |
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液。当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是
| A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.c(Na+) + c(H+)=c(CH3COO-) + c(OH-) |
| D.c(Na+) + c(OH-)=c(CH3COO-) + c(H+) |
下列叙述正确的是
| A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL |
| B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
已知HF酸性强于CH3COOH,常温下有下列三种溶液。有关叙述不正确的是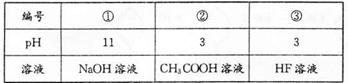
| A.②、③混合后:C(H+)=C(F-)+C(CH3COO-)+ c(OH-) |
| B.①、②等体积混合后:c(CH3COO-)>c(Na+)>C(H+)>c(OH-) |
| C.中和相同体积的②、③,需消耗相同体积的① |
| D.向②加入NaF固体,CH3C00H电离平衡正向移动 |
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |
 (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数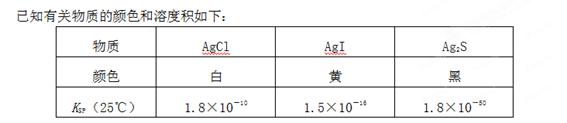
 w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m