题目内容
下列叙述正确的是
| A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL |
| B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
BD
解析试题分析:c(H+)=10—pHmol/L=0.1mol/L,HCl完全电离,CH3COOH部分电离,则c(HCl)= 0.1mol/L,c(CH3COOH)>0.1mol/L,由于n=c?V,则n(HCl)<n(CH3COOH),因此醋酸消耗NaOH溶液的体积较多,大于20.0mL,故A选项错误;由于Na2CO3=2Na++CO32—,钠离子不水解,碳酸根离子存在水解平衡,即CO32—+H2O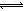 HCO3—+OH—,则向稀碳酸钠溶液中加入少量NaOH固体时,钠离子和氢氧根离子浓度均增大,增大生成物浓度,导致碳酸根离子的水解平衡向逆反应方向移动,则碳酸根离子浓度增大,故B选项正确;氯化银是难溶电解质,因此其悬浊液中存在沉淀溶解平衡,即AgCl(s)
HCO3—+OH—,则向稀碳酸钠溶液中加入少量NaOH固体时,钠离子和氢氧根离子浓度均增大,增大生成物浓度,导致碳酸根离子的水解平衡向逆反应方向移动,则碳酸根离子浓度增大,故B选项正确;氯化银是难溶电解质,因此其悬浊液中存在沉淀溶解平衡,即AgCl(s)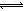 Ag++Cl—,氯化纳是易溶易电离物,加入少量NaCl固体,增大氯离子浓度,上述平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度减小,但温度不变平衡常数不变,则Ksp(AgCl)不变,故C选项错误;由于n=c?V,则n(CH3COONa)=n(CH3COOH),根据物料守恒原理可得,混合溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),故D选项正确。
Ag++Cl—,氯化纳是易溶易电离物,加入少量NaCl固体,增大氯离子浓度,上述平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度减小,但温度不变平衡常数不变,则Ksp(AgCl)不变,故C选项错误;由于n=c?V,则n(CH3COONa)=n(CH3COOH),根据物料守恒原理可得,混合溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),故D选项正确。
考点:考查水溶液中的离子平衡移动及粒子浓度大小关系,涉及等pH等体积的强酸与弱酸溶液中和氢氧化钠溶液体积的大小、盐类水解反应的移动、沉淀溶解平衡的移动、溶度积与平衡移动的关系、等浓度等体积弱酸与强碱弱酸盐溶液混合后溶液中物料守恒关系式等。

 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案在0.1 mol·L-1的NaHS溶液中,下列关系式正确的是
| A.c(Na+)=c(HS-)+2c(S2-)+c(H2S) |
| B.c(HS-)=c(Na+)+c(H+)-c(OH-)-c(S2-) |
| C.c(OH-)=c(H+)+c(H2S)+c(S2-) |
| D.c(H+)=c(OH-)+c(S2-)-c(H2S) |
25℃时下列叙述正确的是
| A.0.10mol·L-1的三种溶液:①NaCl、②NaOH、③CH3COONa,其pH大小顺序为:③>②>① |
| B.0.10mol·L-1NaHCO3溶液中:c(CO32-)+c(HCO3-)+c(H2CO3)=0.10mol·L-1 |
| C.pH=2的盐酸和pH=12的NaOH溶液中,水的离子积Kw相同 |
| D.与体积相同、pH=2的盐酸和醋酸完全反应,需要0.010mol·L-1 NaOH的体积相同 |
对于室温下pH=3的醋酸,下列叙述正确的是
| A.加水稀释后,醋酸的电离程度增大,溶液的导电性增强 |
| B.c(H+)=c(CH3COO-)+c(OH-) |
| C.加入少量醋酸钠固体后,恢复至室温,溶液中c(CH3COO-)?c(H+)/c(CH3COOH)不变 |
| D.与等体积pH=11的NaOH溶液混合后,pH=7 |
室温下,某浓度的醋酸溶液中n(CH3COO-)=0.01mol,下列叙述正确的是
| A.向该醋酸溶液中加入等体积等浓度的盐酸,抑制醋酸的电离,溶液中c(H+)增大 |
| B.若醋酸溶液体积为1L,则c(CH3COOH)=0.01mol/L |
| C.与NaOH恰好中和时,溶液中c(Na+)<c(CH3COO-) |
| D.与等体积等浓度的醋酸钠溶液混合,溶液中c(Na+)+ c(H+)=c(CH3COO-)+ c(OH-) |
下列叙述正确的是
| A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5NA |
| B.常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3×6.02×1023 |
| C.等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.溶液中由水电离出的c(H+)=1×10-12mol/L,SO42-、NO3-、Fe2+、Mg2+能大量共存 |
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,加少量烧碱溶液可使溶液中 CH3COO-+H+,加少量烧碱溶液可使溶液中 值增大。 值增大。 |
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 H++OH-逆向移动,c(H+)降低 |
| C.取c(H+)="0.01" mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-) |
室温下向10 mL pH = 3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
| B.溶液中C(CH3COO-)/C(CH3COOH).c(OH-)不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH = 11的NaOH溶液,混合液pH=7 |
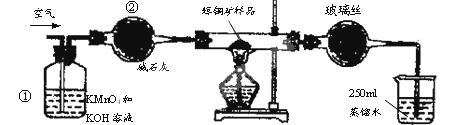
(15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
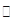 SO2 +2Cu。
SO2 +2Cu。F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。