题目内容
15.用石墨作电极电解CuSO4溶液.通电一段时间后,两电极都产生了气泡,欲使电解液恢复到起始状态,应向溶液中加入适量的( )| A. | CuSO4 | B. | H2O | C. | CuO | D. | Cu(OH)2 |
分析 用石墨作电极电解CuSO4溶液时,阳极上OH-放电生成O2,阴极上先Cu2+放电生成Cu,通电一段时间后,两电极都产生了气泡,说明阴极上氢离子还放电生成氢气,欲使电解液恢复到起始状态,根据“析出什么加入什么”判断需要加入的物质.
解答 解:用石墨作电极电解CuSO4溶液时,阳极上OH-放电生成O2,阴极上先Cu2+放电生成Cu,通电一段时间后,两电极都产生了气泡,说明阴极上氢离子还放电生成氢气,所以析出的物质相当于CuO、H2O,欲使电解液恢复到起始状态,根据“析出什么加入什么”的原则知,需要加入的物质为Cu(OH)2,故选D.
点评 本题考查电解原理,明确离子放电顺序是解本题关键,明确各个电极上析出物质来分析解答,如果Cu(OH)2改写为CuO.H2O,就能迅速做出正确判断,注意解题方法和技巧.

练习册系列答案
相关题目
5.下列化合物中,同分异构体数目超过7个的有( )
| A. | 己烷 | B. | 己烯 | C. | 1,2-二溴丙烷 | D. | 乙苯 |
6.有关H、D、T、HD、H2、D+、H-这七种微粒的说法正确的是( )
| A. | 互为同位素 | B. | 是七种氢元素 | C. | HD和H2均是单质 | D. | 电子数相同 |
3.研究反应:2H2+O2═2H2O.
(1)已知该反应为放热反应,图1能正确表示该反应中能量变化的是A.
(2)已知:拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
根据图2中能量变化图,回答下列问题:
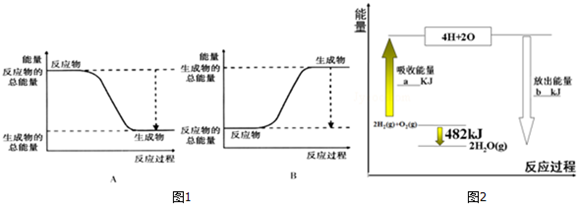
①图2中:a=1370.
②表格中:X=463.
③请写出该反应的热化学方程式:2H2(g)+O2(g)=2H2O (g)△H=-482KJ/mol.
(3)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.其中,氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”).电路中每转移0.2mol电子,标准状况下消耗气体的总体积是3.36 L.
(1)已知该反应为放热反应,图1能正确表示该反应中能量变化的是A.
(2)已知:拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |

①图2中:a=1370.
②表格中:X=463.
③请写出该反应的热化学方程式:2H2(g)+O2(g)=2H2O (g)△H=-482KJ/mol.
(3)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.其中,氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”).电路中每转移0.2mol电子,标准状况下消耗气体的总体积是3.36 L.
10.AgCl悬浊液中存在溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向适量AgCl悬浊液中加入足量1mol/L的HI溶液,振荡后,大部分AgCl转化成了AgI,该反应过程说明( )
| A. | I-的还原性比Cl-强 | B. | AgI的溶解度比AgCl的溶解度大 | ||
| C. | 氢碘酸、盐酸均为强酸 | D. | AgI比AgCl更难溶 |
20.下列离子方程式中,正确的是( )
| A. | 熟石灰与硫酸铵混和研磨 NH4++OH-═NH3↑+H2O | |
| B. | 向KOH溶液中通入少量的SO2 气体 SO2+OH-═HSO3- | |
| C. | 铜片投入稀硝酸中 3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| D. | 氯气通入水中 Cl2+H2O═2 H++Cl-+ClO- |
 X、Y、Z三种短周期元素,它们的原子序数之和为16.Z元素的一种原子核内不含中子,X、Y、Z三种元素的常见单质在常温下都是无色、无味气体,在适当条件下可发生如图变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
X、Y、Z三种短周期元素,它们的原子序数之和为16.Z元素的一种原子核内不含中子,X、Y、Z三种元素的常见单质在常温下都是无色、无味气体,在适当条件下可发生如图变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题: ; C分子中所含化学键的类型是极性键,C分子的空间结构呈三角锥形.
; C分子中所含化学键的类型是极性键,C分子的空间结构呈三角锥形. .
.