题目内容
4.A、B、C、D四种短周期元素,它们的原子序数依次增大,A和B在同一周期,A原子的p亚层有一个空轨道,B原子的p亚层有两个未成对电子,0.1mol C单质能从酸中置换出2.24L氢气(标准状况下),形成的C离子与B离子的电子层结构相同.D离子为阳离子,且D离子的半径在B、C、D离子中为最小.则(1)写出C原子的电子排布式:1s22s22p63s2;其在周期表中的位置是第三周期、ⅡA族.
(2)A单质和B单质充分反应生成的化合物的路易斯结构式是
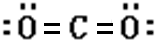 .
.(3)我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1mol这种单质中含中子的物质的量是20mol,则这种同位素原子的符号为818O.
(4)比较C和D的最高价氧化物对应水化物酸性或碱性的强弱:Mg(OH)2>Al(OH)3.
(5)在四种元素中,有一个元素的最高价氧化物对应水化物既能与盐酸反应,又能与氢氧化钠反应.写出这两个反应的离子方程式:3H++A1(OH)3=Al3++3H2O,Al(OH)3+OH-=A1O2-+2H2O.
分析 A、B、C、D四种短周期元素,它们的原子序数依次增大,A原子p能级有一个空轨道,则A为第ⅣA族元素,A和B在同一周期,B原子的p能级有两个未成对电子,则B为ⅥA族元素,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),则C为+2价的活泼金属元素,此时它就变成与B离子电子层排布完全相同的离子,则B在C的上一周期,所以B为氧元素,A为碳元素,C为镁元素,D离子的半径在B、C、D中为最小,则D为铝元素,据此答题.
解答 解:A、B、C、D四种短周期元素,它们的原子序数依次增大,A原子p能级有一个空轨道,则A为第ⅣA族元素,A和B在同一周期,B原子的p能级有两个未成对电子,则B为ⅥA族元素,0.1mol C单质能从酸中置换出 2.24L氢气(标准状态),则C为+2价的活泼金属元素,此时它就变成与B离子电子层排布完全相同的离子,则B在C的上一周期,所以B为氧元素,A为碳元素,C为镁元素,D离子的半径在B、C、D中为最小,则D为铝元素.
(1)C为Mg,原子的电子排布式:1s22s22p63s2,其在周期表中的位置是第三周期ⅡA族,
故答案为:1s22s22p63s2;三、ⅡA;
(2)A单质和B单质充分反应生成的化合物为CO2,路易斯结构式是;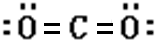 ,
,
故答案为: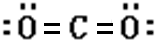 ;
;
(3)1mol这种某种氧气中含中子的物质的量是20mol,则氧原子中子数为10,则这种同位素原子的符号为818O,
故答案为:818O;
(4)金属性Mg>Al,故最高价氧化物对应水化物碱性的强弱:Mg(OH)2>Al(OH)3,
故答案为:Mg(OH)2>Al(OH)3;
(5)氢氧化铝既能与盐酸反应,又能与氢氧化钠反应,反应的离子方程式:3H++A1(OH)3=Al3++3H2O、Al(OH)3+OH-=A1O2-+2H2O,
故答案为:3H++A1(OH)3=Al3++3H2O、Al(OH)3+OH-=A1O2-+2H2O.
点评 本题考查元素位置结构性质关系及应用,涉及核外电子排布、常用化学用语、元素周期律等,正确推断元素的种类为解答该题的关键.

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案| A. | 通过足量的NaOH溶液 | B. | 通过足量的酸性KMnO4溶液 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的溴水 |
| A. | CuSO4 | B. | H2O | C. | CuO | D. | Cu(OH)2 |
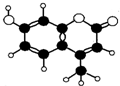 香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②能与Br2水发生取代反应
③能与KOH溶液发生反应
④能使酸性KMnO4溶液褪色
⑤1mol香豆素最多能与5molH2反应.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③④⑤ |
| A. | NO3-、Cu2+、Cl-、NH4+ | B. | K+、CO32-、Ca+、NO3- | ||
| C. | HCO3-、Na+、NO3-、K+ | D. | Cl-、SO42-、Na+、K+ |
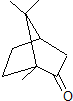 ),下列有关说法正确的是( )
),下列有关说法正确的是( )| A. | 樟脑的分子式为C10H18O | |
| B. | 樟脑中含有2种官能团 | |
| C. | 樟脑在一定条件下可以发生消去反应 | |
| D. | 樟脑有一种特殊的气味,但不属于芳香烃类物质 |