题目内容
5.A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外电子层有4个电子,B的阴离子和C的阳离子有相同的电子层结构,两元素的单质反应,可生成原子个数比为1:1和1:2的两种化合物E、F,D原子的L电子层的电子数等于K、M两个电子层上的电子数之和,请回答下列问题(1)写出四种元素的元素符号:AC;BO;CNa;DS
(2)写出F的电子式
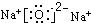
(3)写出D在周期表中的位置第三周期第VIA族
(4)写出A的最高价氧化物与E反应的化学方程式2Na2O2+2CO2=2 Na2CO3+O2 ,每当有1molE参加反应,转移的电子的物质的量为:1mol.
分析 A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,可生成原子个数比为1:1和1:2的两种化合物E、F,则B为O元素、C为Na元素,E为Na2O2,F为Na2O;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,则D为S元素,据此解答.
解答 解:A、B、C、D为四种短周期元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,可生成原子个数比为1:1和1:2的两种化合物E、F,则B为O元素、C为Na元素,E为Na2O2,F为Na2O;A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素;D的L层电子数等于K、M两个电子层上电子数之和,则D原子M层电子数为8-2=6,则D为S元素.
(1)由上述分析可知,A为C元素,B为O元素,C为Na,D为S,故答案为:C;O;Na;S;
(2)F为Na2O,电子式为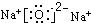 ,故答案为:
,故答案为: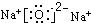 ;
;
(3)D为S元素,在周期表中的位置:第三周期第VIA族,故答案为:第三周期第VIA族;
(4)A的最高价氧化物与E反应的化学方程式:2Na2O2+2CO2=2 Na2CO3+O2 ,反应中过氧化钠起氧化剂、还原剂作用,各占$\frac{1}{2}$,故当有1molE参加反应,转移的电子的物质的量为:1mol×$\frac{1}{2}$×2×[0-(-1)]=1mol,
故答案为:2Na2O2+2CO2=2 Na2CO3+O2 ;1mol.
点评 本题考查结构性质位置关系应用,比较基础,注意对基础知识的积累掌握.

练习册系列答案
相关题目
15.用石墨作电极电解CuSO4溶液.通电一段时间后,两电极都产生了气泡,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
| A. | CuSO4 | B. | H2O | C. | CuO | D. | Cu(OH)2 |
13.香樟树中可提取一种有机物樟脑(键线式如图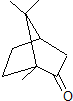 ),下列有关说法正确的是( )
),下列有关说法正确的是( )
 ),下列有关说法正确的是( )
),下列有关说法正确的是( )| A. | 樟脑的分子式为C10H18O | |
| B. | 樟脑中含有2种官能团 | |
| C. | 樟脑在一定条件下可以发生消去反应 | |
| D. | 樟脑有一种特殊的气味,但不属于芳香烃类物质 |
20.都能用氢氧化钠溶液进行喷泉实验的一组气体是( )
| A. | HCl和CO2 | B. | NH3和CO | C. | SO2和CO | D. | NO2和NO |
10.下列各组物质熔化所克服的微粒间的作用力属同种类型的是( )
| A. | 石英和生石灰的熔化 | B. | 冰的熔化和氯化钠的熔化 | ||
| C. | 晶体硅和晶体硫的熔化 | D. | 钠和铁的熔化 |
19.下列变化属于氧化还原反应的是( )
| A. | 馒头在咀嚼过程中产生甜味 | |
| B. | 三氯化铁溶液长期放置产生红褐色固体 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液,析出沉淀 | |
| D. | 植物油长期放置发生“酸败产生刺激性气味” |