题目内容
3.研究反应:2H2+O2═2H2O.(1)已知该反应为放热反应,图1能正确表示该反应中能量变化的是A.
(2)已知:拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |
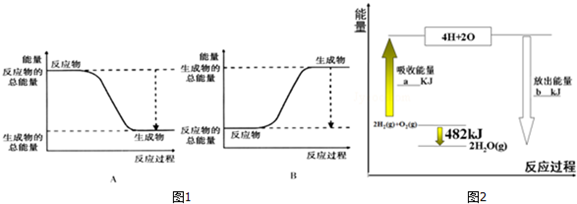
①图2中:a=1370.
②表格中:X=463.
③请写出该反应的热化学方程式:2H2(g)+O2(g)=2H2O (g)△H=-482KJ/mol.
(3)氢氧燃料电池的总反应方程式为2H2+O2═2H2O.其中,氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”).电路中每转移0.2mol电子,标准状况下消耗气体的总体积是3.36 L.
分析 (1)反应物总能量大于生成物总能量,反应为放热反应;
(2)①根据H-H键能、O=O键能计算;
②反应热=反应物总键能-生成物总键能;
③由图可知,2molH2(g)与1molO2(g)反应生成2molH2O(g)放出热量为482kJ;
(3)氢气发生氧化反应,而原电池负极发生氧化反应;
由电子转移守恒可知,转移0.2mol电子参加反应氢气为$\frac{0.2mol}{2}$=0.1mol,结合方程式计算参加反应氧气物质的量,再根据V=nVm计算气体总体积.
解答 解:(1)2H2+O2═2H2O为放热反应,说明反应物总能量大于生成物总能量,图1中A符合,故答案为:A;
(2)①破坏2molH-H键、1molO=O键需要吸收的能量为2mol×436kJ/mol+1mol×498kJ/mol=1370kJ,故答案为:1370kJ;
②反应热=反应物总键能-生成物总键能,则2mol×436kJ/mol+1mol×498kJ/mol-4 E(O-H)=-482kJ/mol,解得E(O-H)=463kJ/mol,故答案为:463;
③由图可知,2molH2(g)与1molO2(g)反应生成2molH2O(g)放出热量为482kJ,热化学方程式为:2H2(g)+O2(g)=2H2O (g)△H=-482KJ/mol,
故答案为:2H2(g)+O2(g)=2H2O (g)△H=-482KJ/mol;
(3)氢气在原电池负极发生氧化反应,由电子转移守恒可知,转移0.2mol电子参加反应氢气为$\frac{0.2mol}{2}$=0.1mol,结合方程式可知,参加反应氧气物质的量为0.1mol×$\frac{1}{2}$=0.05mol,标准状况下消耗气体的总体积是(0.1mol+0.05mol)×22.4L/mol=3.36L,故答案为:负;氧化;3.36.
点评 本题考查反应热计算、热化学方程式书写、吸热反应与放热反应、原电池原理及有关计算,难度不大,侧重对基础知识的巩固.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案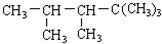 ,则该二烯烃与Br21:1加成后的产物可能有( )
,则该二烯烃与Br21:1加成后的产物可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 通过足量的NaOH溶液 | B. | 通过足量的酸性KMnO4溶液 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的溴水 |
| A. | ①④⑤ | B. | ④⑤⑥ | C. | ③④⑥ | D. | ①②④⑤⑥ |
| A. | CuSO4 | B. | H2O | C. | CuO | D. | Cu(OH)2 |
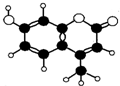 香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )①分子式为C10H9O3
②能与Br2水发生取代反应
③能与KOH溶液发生反应
④能使酸性KMnO4溶液褪色
⑤1mol香豆素最多能与5molH2反应.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③④⑤ |
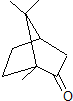 ),下列有关说法正确的是( )
),下列有关说法正确的是( )| A. | 樟脑的分子式为C10H18O | |
| B. | 樟脑中含有2种官能团 | |
| C. | 樟脑在一定条件下可以发生消去反应 | |
| D. | 樟脑有一种特殊的气味,但不属于芳香烃类物质 |