题目内容
【题目】七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在徽生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:
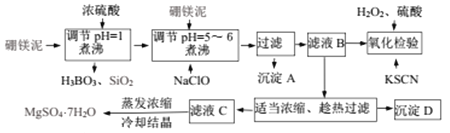
表l:部分阳离子开好成淀和完全沉淀时溶液的pH
Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______(填化学式)。
(3)能否直接控制pH除去Mn2+______,理由__________。
(4)若检验时溶液呈红色,说明滤液B中还含有_______未除尽(填离子符号),应补加_______再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________。
【答案】 5H2O+B4O72-+2H+=4H3BO3 ↓ Fe(OH)3、MnO2 不能 当 Mn2+沉淀完全时,Mg2+也会以沉淀的形式从溶液中析出。 Fe2+ NaClO CaSO4
【解析】试题分析:本题以硼镁泥制取七水硫酸镁的工业流程为依托,重点考查离子方程式的书写、氧化还原反应基础知识、盐类水解在除杂中的应用、常见离子的检验等知识,考查考生对工业流程的分析能力、对试题的综合分析能力和对所学知识的应用能力。解题过程中首先要“吃透”工业流程。
解析:工业流程分析:硼镁泥在稀硫酸作用下,MgCO3、MgO、Na2B4O7、Fe2O3、CaO、Al2O3、MnO等分别反应生成对应的硫酸盐和H3BO3,SiO2不溶为固体,再次的硼镁泥与剩余的硫酸反应、NaClO氧化Mn2+生成MnO2,溶液中可能存在的少量Fe2+被氧化生成Fe3+,同时可以调节溶液的pH值到规定范围,如下图所示。
工业流程中物质转化关系如下:
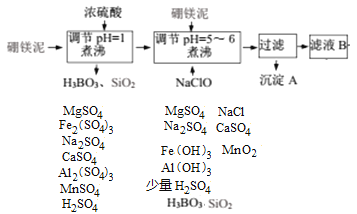
过滤除去的是不溶物Fe(OH)3、Al(OH)3、MnO2、H3BO3、SiO2等,B中主要存在MgSO4及少量Na2SO4、CaSO4、NaCl,适当浓缩、趁热过滤除去溶解度较小的CaSO4,滤液蒸发浓缩、冷却结晶时,析出MgSO4·7H2O。
(1)H3BO3来源于Na2B4O7与H2SO4溶液的反应,Na2B4O7+5H2O+H2SO4=4H3BO3↓+Na2SO4,反应的离子方程式是5H2O+B4O72-+2H+=4H3BO3 ↓ ,正确答案:5H2O+B4O72-+2H+=4H3BO3 ↓。(2)NaClO能够将Fe2+氧化生成Fe3+,而Fe3+在pH为3.2的溶液中就完全沉淀,此时溶液pH5~6,所以生成Fe(OH)3沉淀,Mn2+被氧化生成MnO2。正确答案:Fe(OH)3 MnO2。(3)直接除去Mn2+需要调节溶液pH达到10.1,Mg2+在pH达到9.6时就开始沉淀,因此Mn2+完全沉淀时,Mg2+也部分沉淀而损失,所以不能直接控制pH除去Mn2+。正确答案:不能 、 当 Mn2+沉淀完全时,Mg2+也会以沉淀的形式从溶液中析出。(4)检验时加入的KSCN是为了检验Fe3+,同时加入的H2O2、硫酸说明该Fe3+来源与Fe2+,即滤液B中含有Fe2+,因此第二步需要补加NaClO将Fe2+充分氧化,防止Fe2+盐混入产物中导致产物不纯。正确答案:Fe2+、NaClO。(5)根据上述工业流程分析,沉淀D为CaSO4。正确答案:CaSO4。