题目内容
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g)
ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式: ___________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施):___________________________。
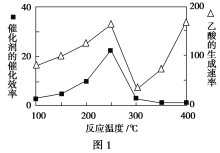
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为_________________________。
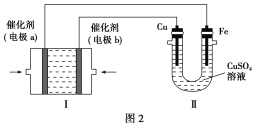
②如图2所示为电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为____________________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填序号)。
a.CuO b.Cu(OH)2
c.CuCO3 d.Cu2(OH)2CO3
【答案】(1)①2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g)
ΔH=-1 096.7 kJ·mol-1 ②高压、低温(或加压、降温)
(2)①正极 CH4-8e-+4O2-===CO2+2H2O
②4OH--4e-===2H2O+O2↑ 1 ac
【解析】(1)①N2(g)+2O2(g)===N2O4(g)
ΔH=+10.7 kJ·mol-1 Ⅰ
N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-543 kJ·mol-1 Ⅱ
根据盖斯定律可知,所求反应的热化学方程式可以由Ⅱ×2-Ⅰ得到:2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 096.7 kJ·mol-1。②四氧化二氮在高温下很难稳定存在,而NO2生成N2O4的反应为气体体积减小的反应,故二氧化氮转化为四氧化二氮的条件可以是高压、低温。(2)①电流从正极流向负极,故c、d分别为正极、负极,燃料电池的负极为通入燃料的一极,故其电极反应式为CH4-8e-+4O2-===CO2+2H2O。②a为电解池的阳极:4OH--4e-===2H2O+O2↑;b为阴极:2Cu2++4e-===2Cu,当阳极产生56 mL气体时,被电解的OH-的物质的量为:![]() ×4=0.01 mol,故溶液中c(H+)=
×4=0.01 mol,故溶液中c(H+)=![]() =0.1 mol·L-1,故溶液的pH=1。此时阴极析出0.05 mol Cu,Cu2+恰好完全放电,为恢复电解质溶液的原状,根据“出什么加什么”原理,只要相当于加入CuO即可,a项可以,b项Cu(OH)2可以拆为CuO·H2O,c项CuCO3拆为CuO·CO2,d项Cu2(OH)2CO3可拆为2CuO·H2O·CO2,其中c项也可选。
=0.1 mol·L-1,故溶液的pH=1。此时阴极析出0.05 mol Cu,Cu2+恰好完全放电,为恢复电解质溶液的原状,根据“出什么加什么”原理,只要相当于加入CuO即可,a项可以,b项Cu(OH)2可以拆为CuO·H2O,c项CuCO3拆为CuO·CO2,d项Cu2(OH)2CO3可拆为2CuO·H2O·CO2,其中c项也可选。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在徽生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______(填化学式)。
(3)能否直接控制pH除去Mn2+______,理由__________。
(4)若检验时溶液呈红色,说明滤液B中还含有_______未除尽(填离子符号),应补加_______再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________。