题目内容
【题目】燃煤烟气脱硫有很多方法
方法I:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4。
方法II:用Na2SO3溶液吸收S02,再经电解转化为H2SO4。
据此回答以下问题:
(1)方法I中发生氧化还原反应的离子方程式__________。能提高方法I燃煤烟气SO2中去除率的措施有__________(填字母)。
A.增大氨水浓度 B.增大燃煤烟气的流速
C.事先去除燃煤烟气中的二氧化碳 D.增大压强
(2)采用方法II脱硫,燃煤烟气中的二氧化碳能否与生成的NaHSO3溶液反应_______(说明理由)。已知H2SO3为的电离平衡常数为K1=1.54×10-2,K2=1.02×10-7。则NaHSO3溶液中含S元素粒子浓度由大到小的顺序为_______。通过右图所示电解装置可将生成的NaHSO3转化为硫酸,电极材料皆为石墨。则A为电解池的______(填“阴极”或“阳极”)。C为______(填物质名称)。若将阴离子交换膜换成阳子交换膜,写出阳极区域发生的电极反应______。

【答案】 2HSO3— +O2=2SO42— +2H+ AD 不能,亚硫酸的酸性大于碳酸 c(HSO3— )>c(SO32— )>c(H2SO3 ) 阴极 较浓的硫酸溶液 4OH--4e-=O2![]() +2H2O或2H2O-4e-=O2
+2H2O或2H2O-4e-=O2![]() +4H+
+4H+
【解析】试题分析:本题以燃煤烟气脱硫为载体,重点考查氧化还原反应方程式书写、化学平衡移动、强酸制取弱酸的原理、离子浓度的比较、电解原理等知识,考查考生对所学化学知识的综合应用能力和对试题的分析能力。
解析:(1)方法(1)反应原理为NH3+H2O+SO2=NH4HSO3,2NH4HSO3+O2=(NH4)2SO4+2H2O,前者不是氧化还原反应,后者属于氧化还原反应,后者离子方程式为:2HSO3- +O2=2SO42- +2H+。提高SO2的去除率,就是设法使NH3+H2O+SO2![]() NH4HSO3的平衡体系正向移动,使更多的SO2发生反应。A、增大氨水浓度可以是使上述平衡正向移动,A正确。B、增加燃煤烟气流速时,虽然参加反应的SO2增加,但是通入的SO2总量增加量更多,参加反应的SO2所占比例减小,即SO2的去除率减小,B错误。C、事先除CO2后,烟气中SO2浓度增大,所以通入的烟气中SO2增加,参加反应的SO2增加,与B分析相似,通入的SO2总量增加量更多,参加反应的SO2所占比例减小,即SO2的去除率减小,C错误。D、加压时,平衡正向移动,D正确。正确答案:2HSO3- +O2=2SO42- +2H+ 、AD 。(2)根据强酸制备弱酸的原理,由于H2SO3酸性比H2CO3强,所以CO2(水溶液中反应生成H2CO3)不能与NaHSO3反应。 NaHSO3溶液中存在HSO3-+H2O
NH4HSO3的平衡体系正向移动,使更多的SO2发生反应。A、增大氨水浓度可以是使上述平衡正向移动,A正确。B、增加燃煤烟气流速时,虽然参加反应的SO2增加,但是通入的SO2总量增加量更多,参加反应的SO2所占比例减小,即SO2的去除率减小,B错误。C、事先除CO2后,烟气中SO2浓度增大,所以通入的烟气中SO2增加,参加反应的SO2增加,与B分析相似,通入的SO2总量增加量更多,参加反应的SO2所占比例减小,即SO2的去除率减小,C错误。D、加压时,平衡正向移动,D正确。正确答案:2HSO3- +O2=2SO42- +2H+ 、AD 。(2)根据强酸制备弱酸的原理,由于H2SO3酸性比H2CO3强,所以CO2(水溶液中反应生成H2CO3)不能与NaHSO3反应。 NaHSO3溶液中存在HSO3-+H2O ![]() H2SO3 +OH-,水解平衡常数
H2SO3 +OH-,水解平衡常数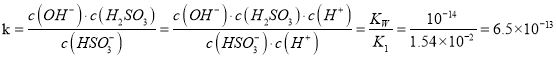 ,K<K2,因此HSO3-在溶液中以电离为主,也存在少量HSO3-的水解,但是电离及水解程度都很小,所以没有水解的HSO3-仍然是主要的存在形式,电离生成的SO32- 次之,水解生成的H2SO3最少,即c(HSO3- )>c(SO32- )>c(H2SO3 )。电解时,由HSO3-转变成SO42-的过程中S元素失去电子被氧化,该反应在阳极发生。反应原理为HSO3--2e-+H2O=SO42-+3H+,生成的H+使阳极区域酸性增强,部分HSO3-与H+反应生成SO2气体。阴极2H++2e-=H2↑,所以A是电解池的阴极,B是阳极。从阴极通入的NaHSO3的HSO3-通过阴离子交换膜进入阳极,放电生成SO42-,使得阳极区域通入的稀硫酸转变成较浓的硫酸后导出,所以C导出的是较浓的硫酸。如果将阴离子交换膜改成阳离子交换膜,则HSO3-离子不能进入阳极区域,则阳极区域OH-放电生成O2,即4OH--4e-=O2
,K<K2,因此HSO3-在溶液中以电离为主,也存在少量HSO3-的水解,但是电离及水解程度都很小,所以没有水解的HSO3-仍然是主要的存在形式,电离生成的SO32- 次之,水解生成的H2SO3最少,即c(HSO3- )>c(SO32- )>c(H2SO3 )。电解时,由HSO3-转变成SO42-的过程中S元素失去电子被氧化,该反应在阳极发生。反应原理为HSO3--2e-+H2O=SO42-+3H+,生成的H+使阳极区域酸性增强,部分HSO3-与H+反应生成SO2气体。阴极2H++2e-=H2↑,所以A是电解池的阴极,B是阳极。从阴极通入的NaHSO3的HSO3-通过阴离子交换膜进入阳极,放电生成SO42-,使得阳极区域通入的稀硫酸转变成较浓的硫酸后导出,所以C导出的是较浓的硫酸。如果将阴离子交换膜改成阳离子交换膜,则HSO3-离子不能进入阳极区域,则阳极区域OH-放电生成O2,即4OH--4e-=O2![]() +2H2O。正确答案:不能,亚硫酸的酸性大于碳酸、 c(HSO3- )>c(SO32- )>c(H2SO3 ) 、阴极、较浓的硫酸溶液 、 4OH--4e-=O2
+2H2O。正确答案:不能,亚硫酸的酸性大于碳酸、 c(HSO3- )>c(SO32- )>c(H2SO3 ) 、阴极、较浓的硫酸溶液 、 4OH--4e-=O2![]() +2H2O或2H2O-4e-=O2
+2H2O或2H2O-4e-=O2![]() +4H+。
+4H+。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】七水硫酸镁(MgSO4·7H2O)可用于印染加重剂,制造瓷器、颜料和防火材料。在医药上用作泻剂,在徽生物工业作培养基成分等。可利用化工厂生产硼砂的废渣——硼镁泥制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、Na2B4O7、SiO2、Fe2O3、CaO、Al2O3、MnO等)。
硼镁泥制取七水硫酸镁的工艺流程图如下:

表l:部分阳离子开好成淀和完全沉淀时溶液的pH
Fe3+ | Fe2+ | Mn2+ | Mg2+ | Al3+ | |
开始沉淀的pH | 1.9 | 7.9 | 8.6 | 9.6 | 3.1 |
完全沉淀的pH | 3.2 | 9.0 | 10.l | 11 | 5.4 |
据此试回答下列问题:
(1)写出生成H3BO3的离子方程式______________。
(2)NaClO具有强氧化性,能直接将溶液中Fe2+和Mn2+分别氧化成______(填化学式)。
(3)能否直接控制pH除去Mn2+______,理由__________。
(4)若检验时溶液呈红色,说明滤液B中还含有_______未除尽(填离子符号),应补加_______再煮沸趁热过滤(填化学式)。
(5)沉淀D的化学式_______________。
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。

① 该反应的焓变ΔH____________0(填“<”、“>”或“=”)。② T1和T2温度下的平衡常数大小关系是K1____________K2(填“<”、“>”或“=”)。③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①平衡常数K=________________。
②若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时V正______V逆(填“<”、“>”或“=”)。
(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。


① 该电池工作时,b口通入的物质为____________。
② 该电池正极的电极反应式为 ___________________。
③ 工作一段时间后,当3.2g甲醇完全反应生成CO2时,有___________NA个电子转移。
(4)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):_______________ 。
