题目内容
7.已知U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.U、V、W和X、Y分别为同一周期的主族元素,V原子p能级电子总数与s能级电子总数相等.U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍.X和Y原子的第一至第四电离能如表所示:| 电离能/kJ/mol | I1 | I2 | I3 | I4 |
| X | 738 | 1451 | 7733 | 10540 |
| Y | 578 | 1817 | 2745 | 11575 |
(2)基态Z原子的核外电子排布式为[Ar]3d54s1.该基态原子共有24种不同运动状态的电子.
(3)试写出U元素单质的2种等电子体,①CO,②CN-.
(4)将W的单质通入NaOH溶液中可得到VW2.VW2是一种无色、几乎无味的剧毒气体,主要用于氧化反应,火箭工程、助燃剂等.
①VW2中V原子的杂化轨道类型是sp3,VW2分子的空间构型为V形.
②与H2O分子相比,VW2分子的极性更小(填“大”或“小”),原因是F的电负性大于O,导致正负电荷中心偏离程度减小.
(5)金属Z内部原子的堆积方式与Na相同,都是体心立方堆积方式.则晶胞中Z的配位数为8,若该晶胞的边长为289pm,NA取值为6.02×1023,Z原子的摩尔质量为52g/mol,则Z的密度为7.1g/cm3.Z原子与次近的Z原子的核间距离为289pm.
分析 U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.V原子p能级电子总数与s能级电子总数相等,核外电子排布为1s22s22p4,则V为O元素;U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍,Z原子核外电子数为24,故Z为Cr元素,U的原子序数小于氧,则最外层电子排布为2s22p3,故U为N元素;根据X和Y原子的第一至第四电离可知,X的第3电离能剧增,则X为Mg元素;Y的第4电离能剧增,则Y为Al元素,U、V、W为同一周期的主族元素,则W为F元素,据此解答.
解答 解:U、V、W、X、Y、Z均为元素周期表中前36号元素,且原子序数依次增大.V原子p能级电子总数与s能级电子总数相等,核外电子排布为1s22s22p4,则V为O元素;U、Z原子中未成对电子数是同周期中最多的,且基态Z原子核外电子数是基态V原子核外电子数的3倍,Z原子核外电子数为24,故Z为Cr元素,U的原子序数小于氧,则最外层电子排布为2s22p3,故U为N元素;根据X和Y原子的第一至第四电离可知,X的第3电离能剧增,则X为Mg元素;Y的第4电离能剧增,则Y为Al元素,U、V、W为同一周期的主族元素,则W为F元素.
(1)同周期自左而右电负性增大,故故电负性:F>O>N;Mg原子价电子排布为3s2,而Al原子的价电子排布为3s23p1,Mg原子3s轨道全充满,3p轨道全空相对稳定,故Mg的第一电离能相对较大,
故答案为:F>O>N;Mg原子价电子排布为3s2,而Al原子的价电子排布为3s23p1,Mg原子3s轨道全充满,3p轨道全空相对稳定;
(2)Cr的核外电子数为24,有24种不同运动状态的电子,其原子的核外电子排布式为[Ar]3d54s1,
故答案为:[Ar]3d54s1;24;
(3)N2有14个电子,其等电子体有:CO、CN-,
故答案为:CO、CN-;
(4)①OF2中,O原子与F形成2条共价键,还有2个孤对电子,形成4个杂化轨道,采用sp3杂化,构成V形空间结构,
故答案为:sp3;V形;
②F的电负性大于O,导致正负电荷中心偏离程度减小,OF2分子的极性小于H2O,
故答案为:小;F的电负性大于O,导致正负电荷中心偏离程度减小;
(5)金属Cr内部原子的堆积方式与Na相同,都是体心立方堆积方式,该晶胞中心Cr与顶点8个Cr最近,其配位数为8;
晶胞中Cr原子数目为1+8×$\frac{1}{8}$=2,晶胞质量为2×$\frac{52}{6.02×1{0}^{23}}$g,晶胞体积=(289×10-10cm)3,则Cr的密度为2×$\frac{52}{6.02×1{0}^{23}}$g÷(289×10-10cm)3=7.1g/cm3;
Cr原子与次近的Cr原子为另一个相邻的晶胞中心Cr原子,其核间距离为边长为289pm,
故答案为:8;7.1;289.
点评 本题是对物质结构和性质的考查,涉及电负性、电离能、核外电子排布、等电子体、分子结构与性质、晶胞计算等,需要学生具备扎实的基础,注意第一电离能的规律及异常现象,难度中等.

 阅读快车系列答案
阅读快车系列答案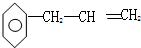 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 能使高锰酸钾溶液褪色 | B. | 能使溴水褪色,且静置后分层 | ||
| C. | 不能发生取代反应 | D. | 可以燃烧 |
| A. | Na2CO3 | B. | AlCl3 | C. | Na2SO3 | D. | NH4HCO3 |
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后计算:
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后计算: .
.