题目内容
【题目】目前汽车尾气中的NO处理有以下几种方法:
(1)在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H 。
N2(g)+2CO2(g) △H 。
①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1,2C(s)+O2(g)=2CO(g)△H3=-221kJ·mol-1,则△H=______。
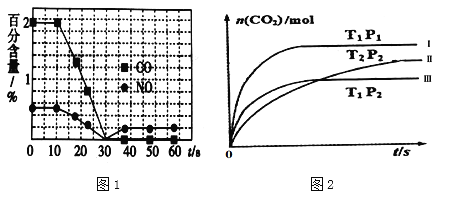
②一个兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化如图1所示,前0﹣10s 阶段,CO、NO百分含量没明显变化的原因是_____________________。同时该小组在固定容积为2L的密闭容器中通入NO和CO各2mol进行反应,n(CO2)随温度(T)、压强(P)和时间(t)的变化曲线如图2所示,图中的曲线Ⅰ、Ⅱ、Ⅲ对应反应从开始到平衡时用CO2表示的平均反应速率分别为v(Ⅰ)、v(Ⅱ)、v(Ⅲ),则三者大小关系为______________。
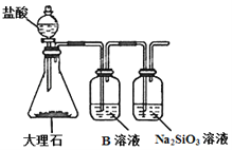
(2)活性炭也可用于处理汽车尾气中的NO。在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
活性炭/mol | NO/mol | CO2/mol | N2/mol | P/MPa | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.0250 | 4.56 |
容器中发生反应的化学方程式为C(s) +2NO(g) CO2(g) +N2(g);根据上表数据,并判断X_____200℃(用“>”、“<“或“=”填空),计算反应体系在200℃时的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(3)用间接电化学法除去NO的过程,如图所示。已知电解池的阴极室中溶液的pH在4~7之间,B极为_________(填“阳极”或“阴极”);写出A极的电极反应式:____________。

【答案】-746.5 温度低,催化剂活性低,反应速率慢 v(Ⅰ)> v(Ⅲ)> v(Ⅱ) > 0.5625 阳极 2HSO3- +2H+ +2e-=S2O42-+2H2O
【解析】
(1)①根据盖斯定律计算2CO(g)+2NO(g)![]() N2(g)+2CO2(g)的△H;②根据影响反应速率的因素分析;汽车冷启动时温度低,反应速率慢;根据曲线的拐点时间来确定化学反应速率的大小;(2)同体积、同物质的量,气体压强随温度升高而增大;根据平衡常数表达式计算Kp;(3)A极HSO3-
N2(g)+2CO2(g)的△H;②根据影响反应速率的因素分析;汽车冷启动时温度低,反应速率慢;根据曲线的拐点时间来确定化学反应速率的大小;(2)同体积、同物质的量,气体压强随温度升高而增大;根据平衡常数表达式计算Kp;(3)A极HSO3-![]() S2O42-,硫元素化合价降低,A为阴极,B为阳极。
S2O42-,硫元素化合价降低,A为阴极,B为阳极。
(1)① Ⅰ、N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1;
Ⅱ、C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1;
Ⅲ、2C(s)+O2(g)=2CO(g)△H3=-221kJ·mol-1,根据盖斯定律Ⅱ×2-Ⅰ-Ⅲ得2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=(-393.5)×2-180.5+221=-746.5 kJ·mol-1;
N2(g)+2CO2(g) △H=(-393.5)×2-180.5+221=-746.5 kJ·mol-1;
②汽车冷启动时温度低,催化剂活性低,反应速率慢,所以前0﹣10s 阶段,CO、NO百分含量没明显变化;根据图象中达到平衡所用时间,可知反应速率v(Ⅰ)> v(Ⅲ)> v(Ⅱ);
(2)同体积、同物质的量,气体压强随温度升高而增大,达到平衡时,2组实验气体的总物质的量相同,容器体积相等,温度越高压强越大,所以X>200℃;Kp=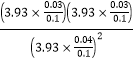 =0.5625;
=0.5625;
(3)A极HSO3-![]() S2O42-,硫元素化合价降低,A为阴极、B为阳极,A极的电极反应式为2HSO3- +2H+ +2e-=S2O42-+2H2O。
S2O42-,硫元素化合价降低,A为阴极、B为阳极,A极的电极反应式为2HSO3- +2H+ +2e-=S2O42-+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。
(1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:

①实验ⅰ的现象说明,得电子的物质是_______________________________。
②碳粉的作用是___________________________________________________。
③为了说明NaCl的作用,需要补充的对照实验是_____________________。
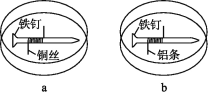
(2)向如图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。

①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作________极。
②加热后,指针发生偏转的原因可能是_____________________。
(3)用(2)中图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。
实验 | a | b | 指针偏转方向 |
I | 0.1% | 0.01% | 向右 |
II | 0.1% | 3.5% | 向左 |
Ⅲ | 3.5% | 饱和溶液 | 向右 |
①Ⅱ中,b中电极发生的电极反应式是_______________________________。
②Ⅲ中,铁在饱和NaCl溶液中不易被腐蚀。查阅资料可知:在饱和NaCl溶液中O2浓度较低,钢铁不易被腐蚀。设计实验证明:_______________________________。
(4)根据上述实验,对钢铁腐蚀有影响的因素是_______________________________。