题目内容
【题目】如下图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
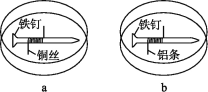
A. a中铁钉发生反应:Fe-3e-=Fe3+
B. b中铁钉上发生还原反应
C. a中铜丝上发生氧化反应:O2+2H2O+4e-=4OH-
D. b中铝条附近有气泡产生
【答案】B
【解析】
a中构成的是铁铜原电池,铁作为负极;b中构成铁铝原电池,铝作负极。
A. a中构成的是铁铜原电池,铁作为负极,铁钉发生反应:Fe-2e-=Fe2+,故A错误;
B.b中构成铁铝原电池,铝作负极,铁钉上氧气得电子发生还原反应,故B正确;
C. a中构成的是铁铜原电池,铁作为负极,a中铜丝上氧气得电子发生还原反应:O2+2H2O+4e-=4OH-,故C错误;
D. b中构成铁铝原电池,铝作负极,铝条失电子发生氧化反应Al-3e-=Al3+,没有气体生成,故D错误。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】目前汽车尾气中的NO处理有以下几种方法:
(1)在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H 。
N2(g)+2CO2(g) △H 。
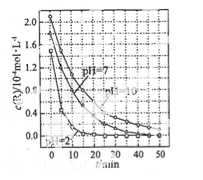
①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,C(s)+O2(g)=CO2(g) △H2=-393.5 kJ·mol-1,2C(s)+O2(g)=2CO(g)△H3=-221kJ·mol-1,则△H=______。
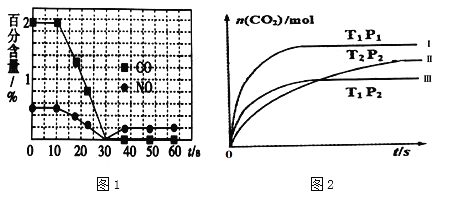
②一个兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化如图1所示,前0﹣10s 阶段,CO、NO百分含量没明显变化的原因是_____________________。同时该小组在固定容积为2L的密闭容器中通入NO和CO各2mol进行反应,n(CO2)随温度(T)、压强(P)和时间(t)的变化曲线如图2所示,图中的曲线Ⅰ、Ⅱ、Ⅲ对应反应从开始到平衡时用CO2表示的平均反应速率分别为v(Ⅰ)、v(Ⅱ)、v(Ⅲ),则三者大小关系为______________。
(2)活性炭也可用于处理汽车尾气中的NO。在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成CO2、N2两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
活性炭/mol | NO/mol | CO2/mol | N2/mol | P/MPa | |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.0250 | 4.56 |
容器中发生反应的化学方程式为C(s) +2NO(g) CO2(g) +N2(g);根据上表数据,并判断X_____200℃(用“>”、“<“或“=”填空),计算反应体系在200℃时的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
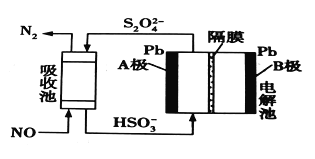
(3)用间接电化学法除去NO的过程,如图所示。已知电解池的阴极室中溶液的pH在4~7之间,B极为_________(填“阳极”或“阴极”);写出A极的电极反应式:____________。