题目内容
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有___种不同的伸展方向,有___种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式___。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成氧化物形式___。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式为___。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为___。
(4)用铝和金属氧化物反应制备金属单质是工业上常用的方法。如:2Al+4BaO![]() 3Ba↑+BaOAl2O3。常温下Al的金属性比Ba的金属性___(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是___。
3Ba↑+BaOAl2O3。常温下Al的金属性比Ba的金属性___(选填“强”“弱”)。利用上述方法可制取Ba的主要原因是___。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaOAl2O3比Al2O3稳定 d.Ba的沸点比Al的低
【答案】4 13 GaCl3+3NH3·H2O=3NH4Cl+Ga(OH)3↓ Na2O·CaO·6SiO2 SiO2+2NaOH= Na2SiO3+H2O CaAl2Si2O8 弱 d
【解析】
铝原子核外有13个电子,其运功状态各不相同。镓与铝同族,所以镓的氯化物和氨水的反应可以类比氯化铝与氨水的反应。铝位于周期表第三周期IIIA族,钡位于第六周期第IIA族。
(1)铝原子的电子排布为1s22s22p63s22p1,13个电子的运动状态各不相同,其中包含s能级的1种轨道和p能级的3种轨道,一共四种轨道,即有4个不同的伸展方向;
(2)类比氯化铝与氨水的反应,可知镓的氯化物和氨水反应的化学方程式为GaCl3+3NH3·H2O=3NH4Cl+Ga(OH)3↓;
(3)Na2CaSi6O14写成氧化物形式为Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,是因为氢氧化钠与玻璃中的二氧化硅反应:SiO2+2NaOH=Na2SiO3+H2O。由钠长石化学式NaAlSi3O8可知,O原子的物质的量分数为![]() 。根据不同类长石其氧原子的物质的量分数相同,则一分子钙长石含有13个原子,其中O为8,假设钙、铝、硅的原子个数分别为x、y、z,则x+y+z=5,根据化合物中化合价代数和为0可知,x+3y+4z=16,联立方程可得,x=1、y=2、z=2,钙长石的化学式为CaAl2Si2O8;
。根据不同类长石其氧原子的物质的量分数相同,则一分子钙长石含有13个原子,其中O为8,假设钙、铝、硅的原子个数分别为x、y、z,则x+y+z=5,根据化合物中化合价代数和为0可知,x+3y+4z=16,联立方程可得,x=1、y=2、z=2,钙长石的化学式为CaAl2Si2O8;
(4)根据元素周期律可知,常温下Al的金属性比Ba弱,利用2Al+4BaO![]() 3Ba↑+BaOAl2O3可制取Ba,是利用Ba的沸点比Al低,高温时Ba转化为气体逸出,使反应正向进行。
3Ba↑+BaOAl2O3可制取Ba,是利用Ba的沸点比Al低,高温时Ba转化为气体逸出,使反应正向进行。

 名校课堂系列答案
名校课堂系列答案【题目】碳酸氢纳俗称“小苏打”,是氨碱法和联合制碱法制纯碱的中间产物,可用作膨松剂,制酸剂,灭火剂等。工业上用纯碱溶液碳酸化制取碳酸氢钠。
(1)某碳酸氢钠样品中含有少量氯化钠。称取该样品,用0.1000mol/L盐酸滴定,耗用盐酸20.00mL。若改用0.05618mol/L硫酸滴定,需用硫酸____________mL(保留两位小数)。
(2)某溶液组成如表一:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 814.8 | 400.3 | 97.3 |
问该溶液通入二氧化碳,析出碳酸氢钠晶体。取出晶体后溶液组成如表二:
化合物 | Na2CO3 | NaHCO3 | NaCl |
质量(kg) | 137.7 | 428.8 | 97.3 |
计算析出的碳酸氢钠晶体的质量(保留1位小数)。____________
(3)将组成如表二的溶液加热,使碳酸氢钠部分分解,溶液中NaHCO3的质量由428.8kg降为400.3kg,补加适量碳酸钠,使溶液组成回到表一状态。计算补加的碳酸钠质量(保留1位小数)。____________
(4)某种由碳酸钠和碳酸氢钠组成的晶体452kg溶于水,然后通入二氧化碳,吸收二氧化碳44.8×103L(标准状况),获得纯的碳酸氢钠溶液,测得溶液中含碳酸氢钠504kg。通过计算确定该晶体的化学式____________
【题目】能源、材料已成为当今科学研究的热点。请回答下列问题:
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示。若该原子核外电子有三层,则该元素位于周期表______族,写出A燃烧后形成的氧化物的电子式:______.
I1 | I2 | I3 | I4 | … | |
电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |
(2)如图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是______(填元素符号),其原子最外层有______种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式:______。
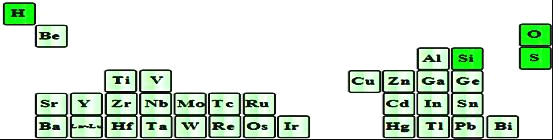
(3)上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为______,该物质为______分子(选填“极性”或“非极性”)。
(4)铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1mol该易燃气体放出37.68kJ热量,请写出此反应的热化学方程式:______。
(5)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应。下列叙述正确的是______(选填编号)。
a.Mg作负极,Al作正极
b.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少2/3
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2。