题目内容
【题目】实验室中所用少量氯气是用下列方法制取的,MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,试回答下列问题:
MnCl2+Cl2↑+2H2O,试回答下列问题:
(1)该反应是氧化还原反应吗?__________(填“是”或“否”),如果是氧化还原反应,请指出__________是氧化剂,______________是还原剂,____________是氧化产物,______________是还原产物,根据上述氧化还原反应判断氧化性:__________>__________;还原性:__________>____________。
(2)写出该反应的离子方程式______________________________。
(3)用双线桥法标出该反应电子转移的方向和数目__________________________________。
【答案】是 MnO2 HCl Cl2 MnCl2 MnO2 Cl2 HCl MnCl2 4H++2Cl-+MnO2=Cl2↑+Mn2++2H2O 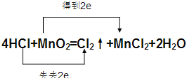
【解析】
(1)依据化合价变化判断,元素化合价升高的物质作还原剂被氧化得到氧化产物;元素化合价降低的物质作氧化剂被还原发生还原反应,得到还原产物;氧化还原反应中的氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物;
(2)依据化学方程式写出离子方程式;
(3)双线桥标注电子得失方向和数目.
(1)元素化合价升高的物质作还原剂被氧化得到氧化产物;元素化合价降低的物质作氧化剂被还原发生还原反应,得到还原产物;氧化还原反应中的氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物;反应前后有元素化合价变化,说明是氧化还原反应;锰元素化合价从+4价变化为+2价,化合价降低作氧化剂被还原为还原产物氯化锰;氯化氢中氯元素化合价升高从-1价变化为0价,化合价升高作还原剂被氧化得到氧化产物Cl2,;氧化还原反应中氧化剂MnO2的氧化性大于氧化产物Cl2,还原剂HCl的还原性大于还原产物MnCl2;
故答案为:是;MnO2;HCl;Cl2;MnCl2;MnO2>Cl2;HCl>MnCl2;
(2)反应中二氧化锰难溶于水,反应的离子方程式为:4H++2Cl-+MnO2=Cl2↑+Mn2++2H2O;
(3)氧化还原反应中锰元素化合价从+4价降低到+2价;得到电子被还原;HCl中的氯元素化合价从-1价升高到0价失去电子被氧化;双线桥标注为: 。
。

【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将电石与水反应产生的气体通入酸性高锰酸钾溶液 | 溶液紫色褪去 | 证明有乙炔生成 |
B | 取CH3COONa溶液于试管中并加入几滴酚酞,再加热 | 溶液红色加深 | CH3COONa溶液显碱性且存在水解平衡 |
C | 向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸 | 无红色沉淀生成 | 蔗糖没有发生水解反应生成葡萄糖 |
D | 向Na2S2O3溶液中滴加H2SO4溶液至过量 | 一段时间后溶液变浑浊 | Na2S2O3在该反应中只作氧化剂 |
A.AB.BC.CD.D