题目内容
14. 短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)T位于周期表中第三周期ⅢA族.用化学方程式表示工业上冶炼该单质的反应原理2Al2O3(熔融)═4Al+3O2↑.
(2)元素的非金属性:Q>P(填“>”或“<”),可以证明该结论的实验是(用化学方程式
表示)Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3.
(3)R的氢化物的化学式为NH3,实验室检验该氢化物的方法是用镊子夹住湿润的红色石蕊(或pH)试纸靠近气体,观察到试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生).
分析 短周期元素Q、R、T、P在元素周期表中的位置如图所示,则Q、R位于第二周期,T、P处于第三周期;T所处的周期序数与主族序数相等,则T位于第三周期、ⅢA族,故T为Al元素;根据元素在周期表中的相对位置可知,P为Si元素、Q为C元素、R为N元素,
(1)T为铝元素,原子序数为13,核外电子层数为3,最外层含有3个电子,据此判断其在周期表中位置;工业上通过电解熔融氧化铝的方法获得铝;
(2)P为Si元素、Q为C元素,同一主族中,原子序数越大,非金属性越弱;根据碳酸与硅酸钠溶液反应生成硅酸和碳酸钠可知二者非金属性大小;
(3)R为氮元素,其氢化物为氨气;可以用湿润的红色石蕊试纸或浓盐酸检验氨气.
解答 解:短周期元素Q、R、T、P在元素周期表中的位置如图所示,则Q、R位于第二周期,T、P处于第三周期;T所处的周期序数与主族序数相等,则T位于第三周期、ⅢA族,故T为Al元素;根据元素在周期表中的相对位置可知,P为Si元素、Q为C元素、R为N元素,
(1)T为Al元素,原子序数为13,位于周期表中第三周期、ⅢA族;工业上通过电解熔融氧化铝获得金属铝,反应方程式为:2Al2O3(熔融)═4Al+3O2↑,
故答案为:三;ⅢA; 2Al2O3(熔融)═4Al+3O2↑;
(2)P为Si元素、Q为C元素,非金属性C>Si;通过反应Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O=H2SiO3↓+2 NaHCO3可证明碳元素的非金属性大于硅,
故答案为:>; Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O=H2SiO3↓+2 NaHCO3;
(3)R为N元素,其氢化物为氨气:NH3,实验室中检验氨气的方法为:用镊子夹住湿润的红色石蕊(或pH)试纸靠近气体,观察到试纸变蓝,也可以用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生,
故答案为:NH3;用镊子夹住湿润的红色石蕊(或pH)试纸靠近气体,观察到试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生).
点评 本题考查了元素周期表和元素周期律的应用,题目难度中等,根据信息推断各元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生灵活应用基础知识的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成生物柴油,提高资源的利用率 | |
| C. | 发展光伏发电等高效清洁能源,缓解能源危机 | |
| D. | 大力发展公共交通,提高汽油的质量,对减轻雾霾很有必要 |
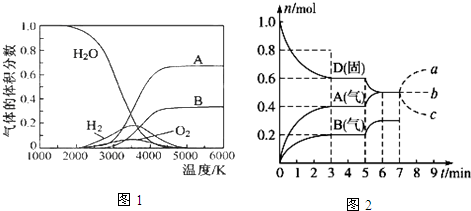
(1)高温下水分解体系中主要物质的体积分数与温度的关系如图1所示.下列说法正确的是C
A.图中A、B表示的粒子依次是O和H
B.图中A、B表示的粒子依次是H+和O2-
C.图中A、B重新生成水时的活化能等于0
D.图中A、B重新生成水时的活化能大于0
(2)已知H2的燃烧热△H=-285.8kJ/mol,且H2O的汽化热为44.0kJ/mol.试写出H2燃烧生成水蒸气的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.
(3)在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图2,据图回答下列问题:
①从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为0.067 mol/(L•min)(保留2位有效数字)
②第5min时,升高温度,A、B、D的物质的量变化如图,则该反应为吸热(填“吸热”或“放热”)反应.
③若在第7min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是b(用图中a、b、c的编号回答)
(4)在100℃、200KPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下,逐步增大体系的压强(维持温度不变),如表列出的是不同压强下反应建立平衡时物质B的浓度.根据表中的数据,回答下列问题:
| 压强(KPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
②压强从500KPa增加到1000KPa时,平衡正向移动(填“正向”、“逆向”或“不移动”),其原因可能为压强增大为原来的两倍,B浓度的变化大于两倍,说明C在增大压强时变为非气体,平衡正向移动.
| A. | 将铜片投入足量稀硝酸中:Cu+NO3-+4H+═Cu2++NO↑+2H2O | |
| B. | 二氧化硅与氢氧化钠溶液反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 硫酸溶液与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 钠与 CuSO4溶液反应:2Na+Cu2+═2Na++Cu |
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O═Ni(OH)2+OH- | |
| C. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| D. | 已知苯甲酸的酸性比碳酸强,向 溶液中通入过量CO2: 溶液中通入过量CO2: +2CO2+2H2O-→ +2CO2+2H2O-→ +2HCO3- +2HCO3- |
| A. | 铁和盐酸:Fe+2H+═Fe3++H2↑ | |
| B. | 石灰石和硝酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜和硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 氢氧化钡溶液和硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | 用铜电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| B. | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| A. | 建立合法、公开的地沟油回收生产制度,将生产的地沟油用作工业用油 | |
| B. | 将生活垃圾分类回收、加工、使之再生、再利用 | |
| C. | 生活污水、工业废水不要乱排放,通过打深井,将之排到地层深处 | |
| D. | 不用一次性筷子、不浪费纸张、不浪费粮食、做“光盘”一族 |

 .
.