题目内容
19.下列离子方程式与所述事实相符且书写正确的是( )| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O═Ni(OH)2+OH- | |
| C. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| D. | 已知苯甲酸的酸性比碳酸强,向 溶液中通入过量CO2: 溶液中通入过量CO2: +2CO2+2H2O-→ +2CO2+2H2O-→ +2HCO3- +2HCO3- |
分析 A.阳极铁放电,该反应中还生成氢氧化亚铁沉淀,不会生成氯气;
B.正极得到电子发生还原反应,该反应为负极反应;
C.C17H35COO-在溶液中部分水解,溶液显示碱性;
D.苯甲酸的酸性大于碳酸,反应中不会生成羧基.
解答 解:A.铁为电极,阳极铁放电,不会生成氯气,正确的电极反应为:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2↓+H2↑,故A错误;
B.正极发生还原反应,正确的电极反应式为:2NiO(OH)+2H2O+2e-═2Ni(OH)2+2OH-,故B错误;
C.由于C17H35COO-在溶液中水解,溶液呈碱性,则肥皂水能够使酚酞变红,水解的离子方程式为:C17H35COO-+H2O?C17H35COOH+OH-,故C正确;
D.已知苯甲酸的酸性比碳酸强,向 溶液中通入过量CO2,反应生成
溶液中通入过量CO2,反应生成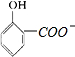 ,正确的离子方程式为:
,正确的离子方程式为: +CO2+H2O→
+CO2+H2O→ +HCO3-,故D错误;
+HCO3-,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确离子方程式的书写原则为解答关键,A为易错点,注意电解为铁,阳极放电的是铁,不是氯离子.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
10.已知H2(g)+I2(g)?2HI(g);△H<0.有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡.欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
| A. | 甲升高温度,乙不变 | B. | 甲中加入0.1molHe,乙不变 | ||
| C. | 甲、乙提高相同温度 | D. | 甲增加0.1molH2,乙不变 |
4.等质量的下列物质中,含分子个数最多的是( )
| A. | Na2O2 | B. | CO2 | C. | H2 | D. | Cl2 |
11.用98%的浓H2SO4(ρ=1.84g/cm3)配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④托盘天平 ⑤50mL烧杯 ⑥10mL量筒 ⑦100mL量筒 ⑧滴定管.
①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④托盘天平 ⑤50mL烧杯 ⑥10mL量筒 ⑦100mL量筒 ⑧滴定管.
| A. | ⑥③⑧⑤①② | B. | ⑥⑤③①⑧② | C. | ④⑤③②①⑧ | D. | ⑥②⑤①③② |
8.下列各组离子在指定条件下一定不能大量共存的是( )
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | c (H+)=0.lmol•L-1的溶液中:Cu2+、A13+、SO42-、NO3- | |
| C. | 能使红色石蕊试纸变蓝的溶液中:K+、CO32-、NO3-、AlO2- | |
| D. | 在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SO42- |
9.下列化学用语表示正确的是( )
| A. | 氟化氢的电子式:H+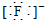 | B. | 氯原子的结构示意图: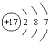 | ||
| C. | 乙酸的分子式:CH3COOH | D. | 1,2-二溴乙烷的结构简式:C2H4Br2 |
 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原): 在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答:
在100mlNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,下图表示加入固体的质量与产生气体的体积(标准状况)的关系,试回答: 短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: