题目内容
11.下列说法中不正确的是( )| A. | 根据某种原子的质量数可以确定该元素的相对原子质量 | |
| B. | H-N=C=O与H-O-C≡N互为同分异构体 | |
| C. | 化学键存在于化合物中,也可能存在于单质中 | |
| D. | 35Cl与37Cl是两种不同的核素 |
分析 A.元素的相对原子质量就是指平均相对原子质量,一种元素有多种原子,元素的相对原子质量是多种原子相对原子质量的平均值(一般根据丰度来计算);
B.同分异构体是指分子式相同,但结构不同的化合物;
C.双原子或多原子分子中存在化学键;
D.质子数相同,而中子数不同的原子互为核素.
解答 解:A.元素的近似相对原子质量=各种天然同位数的质量数乘以各自的丰度(所占百分比),故A错误;
B.H-N=C=O与H-O-C≡N分子式相同,结构不同,互为同分异构体,故B正确;
C.双原子或多原子分子中存在化学键,化学键存在于化合物中,也可能存在于单质中,故C正确;
D.35Cl与37Cl的质子数都是17,中子数分别为18,20,则互为同位素,故D正确.
故选A.
点评 本题考查了同分异构体、化学键和化合物的关系以及核素等,根据物质的构成微粒及微粒间的作用力来分析解答,采用反例法来判断正误.

练习册系列答案
相关题目
1.(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
则X、Y、Z的电负性从大到小的顺序为Al>Mg>Na(用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是因为元素Mg价电子排布式为3s2完全充满状态,比Al稳定.
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型的电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
②M是含有极性键(填“极性”或“非极性”)的非极性分子(填“极性”或“非极性”).
③N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,因而易液化.
④W分子的VSEPR模型的空间构型为四面体形,W分子的空间构型为V形.
⑤AB-离子中和B2分子的π键数目比为1:1.
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1.
①F元素在其化合物中最高化合价为+6.
②G2+离子的核外电子排布式为1s22s22p63s23p63d9,G2+和N分子形成的配离子的结构式为 .
.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1 817 | 2 745 | 11 578 |
| Y | 738 | 1 451 | 7 733 | 10 540 |
| Z | 496 | 4 562 | 6 912 | 9 543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成XYn型的电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取sp3杂化.
①A、B、C的第一电离能由小到大的顺序为C<O<N(用元素符号表示).
②M是含有极性键(填“极性”或“非极性”)的非极性分子(填“极性”或“非极性”).
③N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,因而易液化.
④W分子的VSEPR模型的空间构型为四面体形,W分子的空间构型为V形.
⑤AB-离子中和B2分子的π键数目比为1:1.
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1.
①F元素在其化合物中最高化合价为+6.
②G2+离子的核外电子排布式为1s22s22p63s23p63d9,G2+和N分子形成的配离子的结构式为
 .
.
19.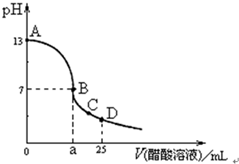 在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )
在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )
 在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )
在25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.2mol?L-1 CH3COOH溶液,曲线如图所示,下列判断正确的是( )| A. | B点,a=12.5 | |
| B. | D点,c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 在A、B间存在一点,此点水的电离程度最大 | |
| D. | 在C点升温,CH3COOH电离程度增大,CH3COO-的水解程度减小 |
16.某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是( )
| A. | 这种元素的相对原子质量为m+n | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若碳原子质量为Wg,此原子的质量为(m+n)Wg | |
| D. | 核内中子的总质量小于质子的总质量 |
3.设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
| A. | 1mol NH3所含有的原子数为NA | |
| B. | 22.4L氧气所含的原子数为2NA | |
| C. | 48g O3所含的氧原子数为3NA | |
| D. | 1 L 0.1mol/L NaCl溶液中所含的Na+为NA |
20.常用的解热镇痛药阿司匹林,其结构简式为:下列关于阿司匹林的叙述不正确的是( )

| A. | 分子式为C9H8O3 | B. | 分子中含有羧基 | ||
| C. | 分子中含有酯基 | D. | 属于芳香族化合物 |