题目内容
2.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-?H++SO42-.请回答下列有关问题:
(1)Na2SO4溶液呈碱性(“酸性”、“中性”或“碱性”),其理由是SO42-+H2O?HSO4-+OH-用离子方程式表示);
NaHSO4溶液呈酸性(“酸性”、“中性”或“碱性”),其理由是HSO4-电离大于水解(HSO4-电离大于水解、HSO4-水解大于电离、HSO4-只电离不水解或HSO4-只水解不电离);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为Ba2++HSO4-═BaSO4↓+H+;
(3)在0.10mol?L-1的Na2SO4溶液中,下列离子浓度关系正确的是BCD(填写编号);
A.[Na+]=[SO42-]+[HSO4-]+[H2SO4]B.[OH-]=[HSO4-]+[H+]
C.[Na+]+[H+]=[OH-]+[HSO4-]+2[SO42-]D.[Na+]=2[SO42-]+2[HSO4-]
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式$\frac{c({H}^{+})c(S{{O}_{4}}^{2-})}{c(HS{{O}_{4}}^{-})}$;
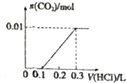
(5)若25℃时,0.10mol?L-1的NaHSO4溶液中[SO42-]=0.029mol?L-1,则0.10mol?L-1的H2SO4溶液中[SO42-]<0.029mol?L-1(填“<”、“>”或“=”),其理由是H2SO4═HSO4-+H+电离出的H+抑制HSO4-的电离
(6)如果25℃时,0.10mol?L-1H2SO4溶液的pH=-lg0.11,则0.10mol?L-1的H2SO4液中[SO42-]=0.01mol?L-1.
分析 (1)硫酸钠中硫酸根离子能水解,呈碱性;NaHSO4溶液中HSO4-电离大于水解;
(2)H2SO4溶液与BaCl2溶液反应生成硫酸钡沉淀;
(3)Na2SO4溶液存在电荷守恒、物料守恒和质子守恒;
(4)根据电离平衡常数公式计算;
(5)依据硫酸在水中的第一步电离是完全的,第二步电离并不完全,结合平衡移动分析判断;
(6)依据氢离子浓度对硫酸氢根离子的电离平衡影响分析判断.
解答 解:(1)Na2SO4溶液存在SO42-+H2O?OH-+HSO4-,溶液呈弱碱性,NaHSO4溶液中HSO4-电离大于水解,溶液呈酸性,
故答案为:碱性;SO42-+H2O?HSO4-+OH-;酸性;HSO4-电离大于水解;
(2)硫酸溶液中存在HSO4-离子,难电离,硫酸与氯化钡溶液反应的离子方程式为:HSO4-+Ba2+=BaSO4↓+H+,故答案为:Ba2++HSO4-═BaSO4↓+H+;
(3)在0.l0mol•L-1的Na2SO4溶液中离子浓度关系:
A.溶液中硫酸完全电离,溶液中没有H2SO4分子,故A错误;
B.溶液中存在质子守恒为:c(OH-)=c( HSO4-)+c(H+),故B正确;
C.溶液中存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-),故C正确;
D.依据物料守恒,c( Na+)=2c(SO42-)+2c(HSO4-),故D正确;
故答案为:BCD;
(4)NaHSO4溶液中存在硫酸氢根离子的电离平衡:HSO4-?H++SO42-,其Ka=$\frac{c({H}^{+})c(S{{O}_{4}}^{2-})}{c(HS{{O}_{4}}^{-})}$,故答案为:$\frac{c({H}^{+})c(S{{O}_{4}}^{2-})}{c(HS{{O}_{4}}^{-})}$;
(5)25℃时,0.10mol•L-1的NaHSO4溶液中c( SO42-)=0.029mol•L-1,则0.10mol•L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c( SO42-)<0.029mol•L-1,
故答案为:<;H2SO4═HSO4-+H+电离出的H+抑制HSO4-的电离;
(6)若25℃时,0.10mol•L-1H2SO4溶液的pH=-lgO.11,C(H+)=0.11mol/L;依据:①H2SO4=H++HSO4-,②HSO4-?H++S042-.①电离出的氢离子浓度为0.10mol/L;所以②电离出的氢离子浓度为0.11mol/L-0.1.mol/L=0.01mol/L;则0.10mol•L-1的H2SO4溶液中c(SO42-)=0.01mol/L,故答案为:0.01.
点评 本题以信息给予为载体考查了弱电解质的电离,注意硫酸第二步电离特点,再结合电离平衡常数公式计算硫酸氢根离子电离平衡常数,为易错题.

 口算题天天练系列答案
口算题天天练系列答案| A. | 罗伯特•洛夫科维茨 | B. | 丹•谢赫特曼 | ||
| C. | 理查德•赫克 | D. | 托马斯•施泰茨 |
①a=b+4;②a+b=8; ③a+b=30; ④a=b+8.
| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
| A. | 根据某种原子的质量数可以确定该元素的相对原子质量 | |
| B. | H-N=C=O与H-O-C≡N互为同分异构体 | |
| C. | 化学键存在于化合物中,也可能存在于单质中 | |
| D. | 35Cl与37Cl是两种不同的核素 |
 短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.
短周期主族元素A、B、C、D、E、F的原子序数依次增大,已知A的原子半径比B的小,B在反应中既不容易得到电子也不容易失去电子,C元素的气态氢化物和其最高价氧化物对应水化物能化合生成盐,元素D的原子最外层电子数是其电子层数的3倍,E与A同一主族,F常用于制半导体.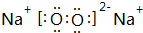
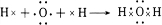 ,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
,写出A2D与X反应的化学方程式,并用单线桥标出电子转移
 .该物质属于共价化合物(填“离子”或“共价”).向X的水溶液中滴加石蕊溶液,会观察到:溶液变红色.并用方程式解释原因NH3+H2O=NH3.H2O?NH4++OH-.
.该物质属于共价化合物(填“离子”或“共价”).向X的水溶液中滴加石蕊溶液,会观察到:溶液变红色.并用方程式解释原因NH3+H2O=NH3.H2O?NH4++OH-. 根据如图回答问题.
根据如图回答问题.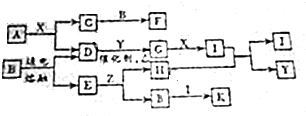
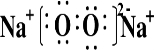 ;
;