题目内容
16.某元素一种同位素原子的质子数为m,中子数为n,则下述论断正确的是( )| A. | 这种元素的相对原子质量为m+n | |
| B. | 不能由此确定该元素的相对原子质量 | |
| C. | 若碳原子质量为Wg,此原子的质量为(m+n)Wg | |
| D. | 核内中子的总质量小于质子的总质量 |
分析 A.无法计算该元素的相对原子质量;
B.无法计算该元素的相对原子质量;
C.若碳原子质量为Wg,此原子的质量为$\frac{1}{12}$(m+n)Wg;
D.质子数和中子数的相对多少未知,无法判断.
解答 解:A.题目已知某元素的一种核素的质子数和中子数,该核素的丰度未知导致无法计算该元素的相对原子质量,故A错误;
B.题目已知某元素的一种核素的质子数和中子数,该核素的丰度未知导致无法计算该元素的相对原子质量,故B正确;
C.该核素的相对原子质量为m+n,该核素的相对原子质量等于该核素的质量与碳-12质量的$\frac{1}{12}$所得的比值,所以该核素的质量为$\frac{1}{12}$(m+n)Wg,故C错误;
D.一个质子的质量和一个中子的质量相当,质子数和中子数的相对多少未知,导致无法判断,故D错误.
故选B.
点评 本题考查了元素的相对原子质量的计算、核素的相对原子质量的计算等知识点,难度不大,明确元素和核素的相对原子质量的计算方法.

练习册系列答案
相关题目
6.2NO2(g)?N2O4(g)达到平衡后下列条件的改变可使NO2气体浓度增大的是( )
| A. | 增大容器的容积 | B. | 再充入一定量的N2O4 | ||
| C. | 分离出一定量的NO2 | D. | 再充入一定量的He |
7.由两种短周期元素组成的化合物,其中两种元素的原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
①a=b+4;②a+b=8; ③a+b=30; ④a=b+8.
①a=b+4;②a+b=8; ③a+b=30; ④a=b+8.
| A. | ①②③④ | B. | ①③④ | C. | ②④ | D. | ③④ |
4.下列中和反应中放出热量最多的是( )
| A. | 100 mL 0.3 mol/L的HCl和50 mL 0.3 mol/L的NaOH相混合 | |
| B. | 80mL 0.3 mol/L的HCl和80 mL 0.3 mol/L的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L的H2SO4和80 mL 0.3 mol/L的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L的H2SO4和50 mL 0.6 mol/L的NaOH溶液相混合 |
11.下列说法中不正确的是( )
| A. | 根据某种原子的质量数可以确定该元素的相对原子质量 | |
| B. | H-N=C=O与H-O-C≡N互为同分异构体 | |
| C. | 化学键存在于化合物中,也可能存在于单质中 | |
| D. | 35Cl与37Cl是两种不同的核素 |
8.氨基酸分子之间通过氨基与羧基间的取代反应可生成多肽与水,现有两种氨基酸间的反应为:aCH3-CH(NH2)COOH+bH2N-(CH2)4CH(NH2)COOH→C30H58O8N10+dH2O,则a:b等于( )
| A. | 4:3 | B. | 2:3 | C. | 3:2 | D. | 3:4 |
5.某短周期元素的L层电子数是M层电子数的2倍,该元素的符号为( )
| A. | C | B. | S | C. | Si | D. | Li |
6.对于可逆反应mA(g)+nB(g)?C(s)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强P的关系如图所示,请判断下列说法正确的是( )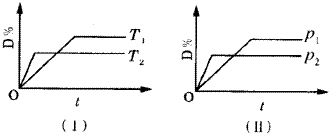

| A. | 降温,化学平衡向正反应方向移动 | |
| B. | 使用催化剂可使%有所增加 | |
| C. | 化学方程式中气体的化学计量数m+n>q | |
| D. | B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
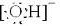 ;C的结构式
;C的结构式 .?
.?