题目内容
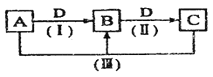
【题目】把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
【答案】B
【解析】
A、B相连时A为负极,则活动性顺序A>B;C、D相连时,电流由D→C,说明C为负极,则活动性顺序:C>D;A、C相连时,C极上产生大量气泡,则C为原电池的正极,活动性顺序:A>C;B、D相连时,D极发生氧化反应,D应为原电池的负极,作为活动性顺序:D>B;则有活动性顺序:A>C>D>B;
故选:B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目