题目内容
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
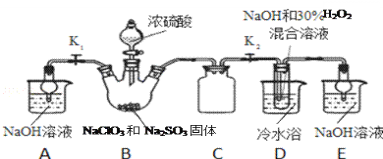
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为________________________;
(2)装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还肯定含有的一种阴离子是________________;检验该离子的方法是________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②__________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________________;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL
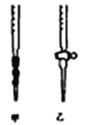
①用Na2S2O3标准溶液滴定时,应将Na2S2O3标准溶液注入________(填“甲”或“乙”)中。
②观察Na2S2O3标准溶液滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致待测溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
③(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为________。
【答案】2NaClO3 +Na2SO3 + H2SO4= 2 ClO2↑+2Na2SO4+ H2O 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 SO42﹣ 取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣ 趁热过滤 NaClO3和NaCl 甲 偏小 cV10﹣3mol
【解析】
装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置C为安全瓶,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体。
(1)装置B中的产物有ClO2气体,则氯酸钠被还原,所以亚硫酸钠被氧化为硫酸钠,方程式为2NaClO3 +Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置D中二氧化氯、氢氧化钠、过氧化氢反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;答案为:2NaClO3 +Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(2)B中生成二氧化氯,则氯酸钠被还原,所以亚硫酸钠被氧化为硫酸钠,且B中还加了浓硫酸,所以D反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还肯定含有的一种阴离子是SO42-;检验该离子的方法是取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣;答案为:SO42﹣;取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣;
(3)根据题中信息可知,NaClO2饱和溶液在低于38℃时析出NaClO23H2O,,高于38℃时析出NaClO2,高于60℃时NaClO2分解,故应趁热过滤,答案为:趁热过滤;
(4)使用冷水浴,说明D中的反应是放热反应。如果撤去D中的冷水浴,温度可能会高于60℃,则NaClO2分解成NaClO3和NaCl,可能导致产品中混有的杂质是NaClO3和NaCl;答案为:NaClO3和NaCl;
(5)①Na2S2O3溶液,因水解显碱性,则用碱式滴定管,使用甲装置;②若滴定前仰视,读数偏大;滴定后俯视,读数偏小,两次读数使标准液的实际体积大于读数体积,导致待测液浓度偏小;③I2+2S2O32﹣=2I﹣+S4O62﹣,n(S2O32﹣)=cmol/L![]() V mL=2n(I2)=4n(ClO2﹣),则25mL溶液中含有n(NaClO2)=
V mL=2n(I2)=4n(ClO2﹣),则25mL溶液中含有n(NaClO2)=![]() c
c![]() V
V![]() 10-3mol,100mL溶液含有n(NaClO2)=c
10-3mol,100mL溶液含有n(NaClO2)=c![]() V
V![]() 10-3mol;答案为:甲;偏小;c
10-3mol;答案为:甲;偏小;c![]() V
V![]() 10-3mol;
10-3mol;

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案

