题目内容
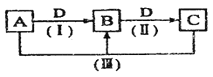
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。
请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:__________________________________(此反应的条件答题时不必写出)。B在工业上用于制备A,反应的化学方程式为:__________________________________。
(2)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,则反应(Ⅲ)的化学方程式______________________________________________,其中氧化产物与还原产物的物质的量之比为______________。
(3)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①D的电子式为________________。
②写出反应(Ⅲ)的离子方程式:________________________________________________。
③取100mL B、C的混合溶液,其中B、C浓度均为0.1mol/L ,向溶液中缓慢滴加0.1mol/L盐酸至过量,收集并测量产生气体的体积。刚开始滴加盐酸时,反应的离子方程式为___________________________。请将产生气体的体积(标准状况下且不考虑产生气体在水中的溶解)随滴加盐酸的体积变化的曲线绘制在下图坐标系中。__________
【答案】4NH3+6NO=5N2+6H2ON2+3H2![]() 2NH32H2S+SO2=3S+2H2O2:1
2NH32H2S+SO2=3S+2H2O2:1![]() OH-+HCO3-=H2O+CO32- H++CO32-=HCO3-
OH-+HCO3-=H2O+CO32- H++CO32-=HCO3-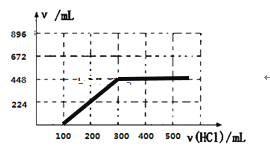
【解析】
(1)B和D为空气的主要成分,即为N2和O2,根据转化关系,A应是连续被氧化,D应为O2,B为N2,则C为NO,A为NH3,反应III的方程式为4NH3+6NO=5N2+6H2O;N2制备NH3,工业方法是合成氨,即反应方程式为N2+3H2![]() 2NH3;
2NH3;
(2)B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,推出B为S,根据转化关系,A为H2S,C为SO2,反应III的方程式为2H2S+SO2=3S+2H2O,H2S为还原剂,SO2为氧化剂,S既是氧化产物又是还原产物,因此氧化产物与还原产物的物质的量之比为2:1;
(3)C为焙制糕点的发酵粉的主要成分,即C为NaHCO3,A、B、C均含有同一种元素,三种物质均显碱性,根据转化关系,推出A为NaOH,B为Na2CO3,D为CO2,①CO2的电子式为![]() ;
;
②反应III的离子方程式为HCO3-+OH-=H2O+CO32-;
③B和C混合构成的溶液为Na2CO3和NaHCO3,向混合液中滴加盐酸,发生H++CO32-=HCO3-,消耗的是盐酸的体积为100mL,此时溶液中NaHCO3的物质的量为(100×10-3×0.1+100×10-3×0.1)mol=0.02mol,继续滴加盐酸发生HCO3-+H+=CO2↑+H2O,此时消耗盐酸的体积200mL,产生CO2的体积为0.02×22.4L=0.448L,即为448mL,图像为:
 。
。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案