题目内容
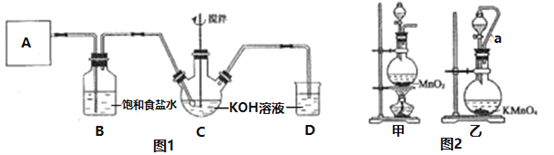
【题目】实验室用图1所示装置制备KClO溶液,并通过KClO溶液与FeCl3溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质: ①可溶于水,微溶于饱和KOH溶液;②在0~5℃的强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
回答下列问题:
(1)装置A用于产生氯气,若选用图2中的甲装置,反应的离子方程式是________,若选用装置乙,其中的导管a的作用是________。
(2)Cl2与KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行。实验中可采取的措施是________;在通入氯气的过程中,不断搅拌的目的是_____________。
(3)制备K2FeO4时,KClO饱和溶液与FeCl3饱和溶液的混合方式为______,反应的离子方程式是____________。
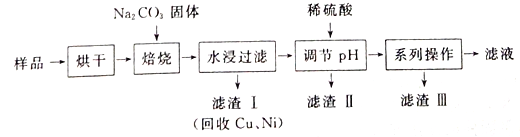
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将K2FeO4粗产品溶于冷的3mol/LKOH溶液中________(填操作名称),将滤液置于冰水浴中,再加入______,搅拌、静置、再过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。
【答案】 MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O 平衡气压,使分液漏斗中的液体能顺利滴下 将装置C中的三颈烧瓶放在冰水浴中 使氯气与碱液充分混合反应,同时及时散热,防止生成杂质 将FeCl3饱和溶液慢慢滴入KClO溶液中 3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O 过滤 饱和KOH溶液
Cl2↑+Mn2++2H2O 平衡气压,使分液漏斗中的液体能顺利滴下 将装置C中的三颈烧瓶放在冰水浴中 使氯气与碱液充分混合反应,同时及时散热,防止生成杂质 将FeCl3饱和溶液慢慢滴入KClO溶液中 3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O 过滤 饱和KOH溶液
【解析】(1)若选用图2中的甲装置制取氯气,实际就是沿用实验室制取氯气的方法,所以其方程式为:MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O。乙装置中的导管a的作用是平衡分液漏斗上方和下方压强,使其中的液体能顺利的滴下来。
Cl2↑+Mn2++2H2O。乙装置中的导管a的作用是平衡分液漏斗上方和下方压强,使其中的液体能顺利的滴下来。
(2)为了保证实验过程在低温下进行,实验时应该将三颈瓶放在冰水浴中。通入氯气时要不断搅拌,除了增大氯气与溶液的接触面积加快反应速率以外,还有使反应放出的热量尽快散发,防止生成氯化钾杂质的目的。
(3)制备K2FeO4时,应该将FeCl3饱和溶液慢慢滴入KClO溶液中,原因是:题目已知K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,所以要保证溶液中基本没有Fe3+,将FeCl3饱和溶液慢慢滴入KClO溶液中,每次加入的少量Fe3+与次氯酸根直接反应,保证了溶液中基本没有Fe3+。ClO-将Fe3+氧化为FeO42-,本身被还原Cl-,反应的方程式为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O。
(4)将K2FeO4粗产品溶于冷的3mol/LKOH溶液中,目的是将高铁酸钾和氯化钾溶入水中(题目说高铁酸钾可溶于水,加入氢氧化钾是为了保证高铁酸钾稳定存在,同时降低氢氧化铁溶解度),经过滤,将滤液置于冰水浴中,再加入饱和氢氧化钾溶液(题目说,高铁酸钾微溶于饱和氢氧化钾溶液)使高铁酸钾析出,再过滤即得产品。

【题目】已知某反应aX(g)+bY(g)=cZ(g)的各物质浓度数据如下:
X | Y | Z | |
起始浓度(molL-1) | 0.3 | 0.5 | 0 |
5s末浓度(molL-1) | 0.1 | 0.4 | 0.3 |
据此可推算出上述化学方程式中X、Y、Z三种物质的化学计量数之比是( )
A.2:1:3
B.3:1:2
C.1:4:3
D.3:2:1