题目内容
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
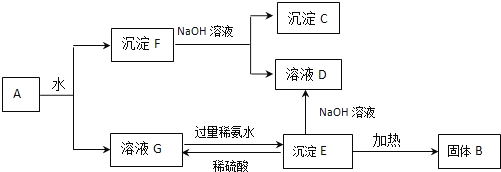
请回答下列问题。
(1)固体B____________、沉淀C____________(填化学式)。
(2)沉淀F与NaOH溶液反应的离子方程式为________________________________。
沉淀E与稀硫酸反应的离子方程式为____________________________________。
溶液G与过量稀氨水反应的离子方程式为________________________________。
【答案】Al2O3 Fe2O3 Al2O3+2OH-=2AlO2-+H2O Al(OH)3+3H+=Al3+ +3H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
根据流程可知:A溶于水得沉淀和溶液,溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁;将沉淀F溶于过量NaOH溶液中,Al2O3能和氢氧化钠反应,Fe2O3和氢氧化钠不反应,所以沉淀C是Fe2O3,溶液D是NaAlO2;溶液G中加入过量的氨水得到沉淀E,则E为Al(OH)3,Al(OH)3与NaOH溶液反应得到NaAlO2,将Al(OH)3加热得到沉淀B,B是Al2O3,氢氧化铝和稀硫酸反应生成硫酸铝和水,据此解答。
根据以上分析可知B是Al2O3,C是Fe2O3,D是NaAlO2,E为Al(OH)3,F是氧化铝和氧化铁,G是硫酸铝。则
(1)B、C的化学式分别是Al2O3、Fe2O3;
(2)沉淀F与NaOH溶液反应的离子方程式为:Al2O3+2OH-=AlO2-+H2O;沉淀E是氢氧化铝,与稀硫酸反应的离子方程式为Al(OH)3+3H+=Al3+ +3H2O;硫酸铝溶液与过量稀氨水反应生成氢氧化铝和硫酸铵,反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案