题目内容
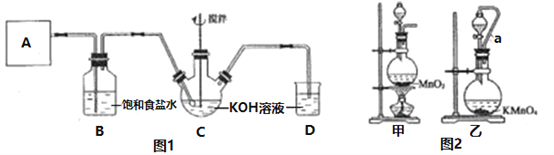
【题目】某学习小组用下图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
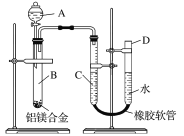
(1)A中试剂为________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是________________________________。
(3)将药品和水装入各仪器中,连接好装置后,需进行的操作还有①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是____________(填序号);记录C的液面位置时,除视线平视外,还应___________________________。
(4)B中发生反应的化学方程式为____________________________________________________。
(5)若实验用的铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将______(填“偏大”“偏小”或“不受影响”)。
【答案】NaOH溶液 除去铝镁合金表面的氧化膜 ⑤①④③② 使D和C中的液面相平 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ ![]() 偏小
偏小
【解析】
(1)观察实验装置图可知是用量气法完成实验目的,故A中应盛NaOH溶液;
(2)目的是除去铝镁合金表面的氧化膜;
(3)正确顺序应为⑤①④③②;为使C中气体的压强与外界大气压相等,还应使D与C的液面相平;
(4)在B中发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑的反应;
(5)依据2Al~3H2,由氢气的体积,计算出铝的相对原子质量;
(6)据w(Al)=(a-c)/a×100%的计算公式可知未洗涤不溶物会造成铝的质量分数偏小。
(1)根据镁、铝的化学性质,镁、铝都能与酸反应放出氢气,但铝还能与碱(如NaOH溶液)反应放出氢气,而镁不能,要测定镁铝合金中铝的质量分数,应选择NaOH溶液,
故答案为:NaOH溶液。
(2)由于镁铝均是活泼的金属,镁铝的表面都容易形成一层氧化膜,则实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是除去铝镁合金表面的氧化膜,故答案为:除去镁铝合金表面的氧化膜。
(3)实验时首先要检查装置的气密性,记录量气管中C的液面位置,然后加入氢氧化钠溶液开始反应,待反应完毕并冷却至室温后,再记录下量气管中C的液面位置,最后将B中剩余固体过滤、洗涤、干燥,称重,所以上述操作的顺序是⑤①④③②;量气管读数时为使里面气体压强与外界大气压相等,所以再记录液面时还需要使D和C的液面相平,故答案为:⑤①④③②,使D和C中的液面相平。
(4)氢氧化钠溶液与铝反应,镁不反应,则B管中发生铝与氢氧化钠溶液反应,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
(5)镁铝合金的质量为ag,B中剩余固体镁的质量为cg,则参加反应的铝的质量是(a-c)g,设铝的相对原子质量为M,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400mL
(a-c)g bmL
解得:M=33600(a-c)/b
故答案为:33600(a-c)/b。
(6)铝的质量分数为(a-c)/a×100%,实验过程中,若未洗涤过滤所得的不溶物,则剩余固体质量偏大,即c偏大,所以测得铝的质量分数将偏小,故答案为:偏小。

【题目】某蓄电池的反为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是_______(填选项字母)。放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是_________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的____(填“正”或“负”)极相连。
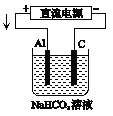
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用两为个相关的方程式表示)①_________________②__________________________。
(4)精炼铜时,粗铜应与直流电源的______(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是____________________________________。乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________。