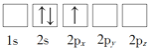
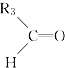
题目内容
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,其中W元素的原子最外层电子数是内层电子数的2倍。下列说法正确的是
![]()
A.原子半径大小:W>Y>Z
B.X的氢化物与Z的氢化物可以发生反应
C.氧化物对应水化物的酸性:Z>Y>W
D.氢化物的稳定性:Y>Z
【答案】B
【解析】
由短周期元素W、X、Y、Z在元素周期表中的相对位置可知,W位于第二周期,W元素的原子最外层电子数是内层电子数的2倍,最外层电子数为2×2=4,可知W为C,结合元素的相对位置可知,X为N,Y为S,Z为Cl,以此来解答。
由上述分析可知,W为C,X为N,Y为S,Z为Cl,
A.一般主族元素的原子电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径为S>Cl>C,故A错误;
B.NH3能和HCl反应生成NH4Cl,故B正确;
C.元素的非金属性Cl>S>C,则最高价氧化物对应水化物的酸性:HClO4>H2SO4>H2CO3,故C错误;
D.元素的非金属性Cl>S,则氢化物的稳定性:HCl>H2S,故D错误;
故答案为B。

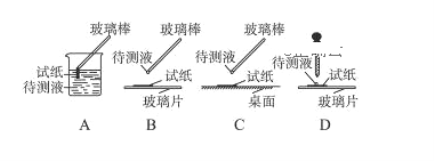
【题目】实验室用 CH3CH2OH 分两步制备 1,2-二溴乙烷。现用少量的溴和足量的乙醇制备 1,2-二溴乙烷的装置如图所示:
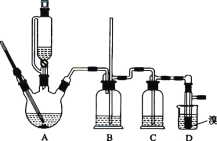
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm -3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A 中发生的化学方程式为 ________,反应类型为 ________,在此制备实验中,要尽可能迅速地把反应温度提高到 170 ℃左右,其最主要目的是 ________________(填字母)。
a.引发反应 b.防止乙醇挥发 c.减少副产物乙醚生成 d.加快反应速率
(2)装置B 的作用是 ________,在装置C 中应加入 ________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(3)装置D 中实验现象为 ________。
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 ________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置 D,其主要目的是 ________________;不用冰水原因 ________。
(6)若制得的产物中混有乙醚,得到纯净的产物的操作是________。
【题目】氨在工农业生产中应用广泛。在压强为30MPa时,不同温度时合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据图中所示,合成氨的热化学方程式为___。
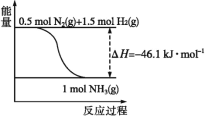
(2)将1molN2(g)和3molH2(g)通入一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“大于”“等于”或“小于”),原因是___;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(3)已知破坏1molN≡N键、1molH—H键需要吸收的能量分别为946kJ、436kJ,则破坏1molN—H键需要吸收的能量为___kJ。
(4)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,以NO2为氧化剂发生反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1。
则1molN2H4与NO2完全反应的热化学方程式为___。
【题目】填写下表中的空格:
微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| _______ | ___________ | ____________ | _____________ |
________ | 18 | 20 | _______________ | __________ |
____________ | ___________ | 16 | 18 | 32 |