题目内容
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)
A.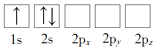 B.
B.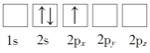
C.![]() D.
D.![]()
(2)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___________,中心原子的杂化形式为___________,LiAlH4中存在___________(填标号)
A.离子键 B.σ键 C.π键 D.氢键
(3)基态K原子中,核外电子占据最高能层的符号是___________,占据该能层电子的电子云轮廓图形状是____________;K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔沸点等都比Cr低,原因是___________
(4)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_____________、_____________
(5)气态三氧化硫以单分子形式存在,其分子的立体构型为_________,其中共价键的类型有____
【答案】D C 正四面体 sp3 AB N 球形 K原子半径较大且价电子数较少,金属性较弱 sp3 sp3 平面三角形 2种
【解析】
(1)原子核外电子排布中,如果电子所占的轨道能级越高,该原子能量越高;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;
=4且不含孤电子对,根据价层电子对互斥理论判断其空间构型;
(3)基态K原子核外有4个电子层,最高能层为第四层,最外层电子为4s1电子,K和Cr属于同一周期,K的原子半径较大,且价电子较少,金属键较弱;
(4) 乙二胺分子中C和N的价层电子对数均为4,VSEPR模型为四面体;
(5)SO3中S原子价层电子对个数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S-O原子之间存在共价键和离域大π键。
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S-O原子之间存在共价键和离域大π键。
(1)原子核外电子排布中,如果电子所占的轨道能级越高,该原子能量越高,根据图知,电子排布能量最低的是1s22s1,即D;电子排布能量最高的是2s12px2,即C;
(2)LiAlH4中的阴离子中Al原子价层电子对个数=4+![]() =4,且不含孤电子对,中心原子的杂化形式为sp3杂化,阴离子空间构型为正四面体形;在LiAlH4中含有离子键和σ键,不存在π键和氢键,故答案为AB;
=4,且不含孤电子对,中心原子的杂化形式为sp3杂化,阴离子空间构型为正四面体形;在LiAlH4中含有离子键和σ键,不存在π键和氢键,故答案为AB;
(3)基态K原子核外有4个电子层,最高能层为第四层,即N层,最外层电子为4s1电子,该能层电子的电子云轮廓图形状为球形,K和Cr属于同一周期,K的原子半径较大,且价电子较少,金属键较弱,则金属K的熔点、沸点等都比金属Cr低;
(4)每个N原子形成3个σ键(2个N-H键、1个N-C键),含有1个孤电子对;每个C原子形成4个σ键,不含孤电子对,根据价层电子对互斥理论判断N、C原子杂化类型分别为sp3、sp3;
(5)SO3中S原子价层电子对个数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种。
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种。

 阅读快车系列答案
阅读快车系列答案【题目】苯甲酸甲酯是重要的化工原料,某化学兴趣小组仿照实验室制乙酸乙酯的原理以苯甲酸和甲醇为原料制备苯甲酸甲酯。有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(gcm-3) | 水溶性 | |
苯甲酸 | 122 | 122.4 | 249 | 1.2659 | 微溶 |
甲醇 | 32 | -97 | 64.6 | 0.792 | 互溶 |
苯甲酸甲酯 | 136 | -12.3 | 196.6 | 1.0888 | 不溶 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,在圆底烧瓶上连接冷凝回流装置后,小心加热2小时,得苯甲酸甲酯粗产品。回答下列问题:
(1)该反应的化学方程式为_____。
(2)实验中,应选择_____(填序号)作为冷凝回流装置,该仪器的名称为_____。

(3)使用过量甲醇的原因是_____。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制。

(4)饱和碳酸钠溶液的作用是_____,操作b的名称为_____。
(5)该实验中制得苯甲酸甲酯8.5g,则苯甲酸甲酯的产率为_____。