题目内容
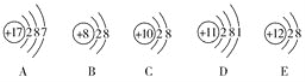
【题目】填写下表中的空格:
微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| _______ | ___________ | ____________ | _____________ |
________ | 18 | 20 | _______________ | __________ |
____________ | ___________ | 16 | 18 | 32 |
【答案】19 21 19 40 ![]() 18 38
18 38 ![]() 2- 16
2- 16
【解析】
根据质量数=质子数+中子数计算。
![]() 含有的质子数为19,中子数为40-19=21,电子数为19,质量数为40;质子数为18,则为Ar,中子数为20,质量数为18+20=38,其符号为
含有的质子数为19,中子数为40-19=21,电子数为19,质量数为40;质子数为18,则为Ar,中子数为20,质量数为18+20=38,其符号为![]() ,电子数为18,质量数为38;质量数为32,中子数为16,则质子数为16,则为S元素,核外电子数比质子数多2,则为硫离子,其符号为
,电子数为18,质量数为38;质量数为32,中子数为16,则质子数为16,则为S元素,核外电子数比质子数多2,则为硫离子,其符号为![]() 2-。
2-。

练习册系列答案
相关题目