题目内容
【题目】某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________________(填代号)。
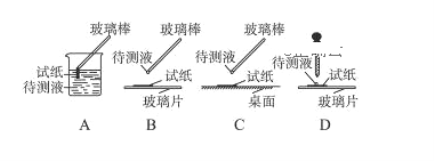
(2)根据上述实验判断原溶液中肯定存在的离子是__________,肯定不存在的离子是_________。
(3)写出与②和③两个实验有关的离子方程式:
②______________________________,③_______________________________。
【答案】BD NO3-、Al3+、SO42- Fe3+、Ba2+、HCO3- 3Cu+8H++2NO3-====3Cu2++2NO↑+4H2O Al3++3NH3·H2O====Al(OH)3↓+3NH4+
【解析】
(1)用试纸检验溶液的酸碱性时,应用玻璃棒蘸取少量溶液(或用胶头滴管滴加)滴在放在玻璃片的试纸上检验;
(2)①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-,溶液无色,则不存在Fe3+;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不会含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡;
根据以上分析解答。
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,据此写出该反应的离子方程式;
③铝离子和一水合氨反应生成氢氧化铝白色沉淀和铵根离子,据此写出该反应的离子方程式。
(1)用试纸检验溶液的酸碱性时,应用玻璃棒蘸取少量溶液(或用胶头滴管滴加)滴在放在玻璃片的试纸上检验;故答案为:BD;
(2)①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-,溶液无色,则不存在Fe3+;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不会含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡,
结合以上分析可知,原溶液中肯定存在的离子是NO3-、Al3+、SO42-;肯定不存在的离子是Fe3+、Ba2+、HCO3-;
综上所述,本题答案是:NO3-、Al3+、SO42-;Fe3+、Ba2+、HCO3-。
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
综上所述,本题答案是: 3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
③Al(OH)3不溶于弱碱,则在含Al3+溶液中加入足量的氨水只生成Al(OH)3,反应的离子方程式为Al3++3NH3H2O═Al(OH)3↓+3NH4+;
综上所述,本题答案是: Al3++3NH3H2O═Al(OH)3↓+3NH4+。

 阅读快车系列答案
阅读快车系列答案