题目内容
15.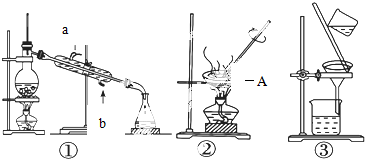
Ⅰ.(1)写出上图中A仪器的名称蒸发皿
(2)冷凝管的进水口为b(填字母)
Ⅱ.实验室要配制2mol/L稀硫酸240mL.
(1)量取18.4mol/L的浓硫酸时,用下面那种规格的量筒②(填序号)
①10ml ②50ml ③100ml ④500ml
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有胶头滴管、250mL容量瓶、玻璃棒等.
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数偏高;
②定容时,液面超过刻度线后用胶头滴管吸至液面处偏低;
③容量瓶事先有水,没干燥无影响
Ⅲ.200ml 5mol/lNaOH溶液中含溶质的质量是40g,取出20ml溶液,其溶质的物质的量浓度是5mol/L.将取出的溶液稀释至100ml,其溶质的物质的量浓度是1mol/L.
分析 I.(1)由图可知,A为蒸发皿;
(2)蒸馏实验中,冷却水下进上出,在冷凝管中时间长,冷却效果好;
Ⅱ.(1)由稀释前后溶质的物质的量不变及容量瓶规格计算;
(2)稀释后转移到容量瓶中定容;
(3)结合c=$\frac{n}{V}$及不当操作分析误差;
Ⅲ.结合n=cV、m=nM及溶液的均一性、稀释前后溶质的物质的量不变计算.
解答 解:I.(1)根据仪器可知,A为蒸发皿,故答案为:蒸发皿;
(2)冷凝管的水流方向和蒸汽方向相反,故进水口为b,出水口为a,故答案为:b;
II.(1)浓硫酸的物质的量浓度为18.4mol/L,由于实验室无240mL容量瓶,故应选择250mL容量瓶,配制出250mL溶液,设所需浓硫酸的体积为VmL,根据稀释定律可知:18.4mol/L×VmL=2mol/L×250mL,解得V=27.2mL,则所需浓硫酸的体积为27.2mL可知,应选择50mL的量筒,故答案为:②;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故除量筒、烧杯外,还必须用到的仪器有胶头滴管、250 mL容量瓶、玻璃棒,故答案为:胶头滴管;250 mL容量瓶;玻璃棒;
(3)①用量筒量取浓硫酸时,仰视量筒进行读数,则所量取的浓硫酸的体积偏大,则配制出的稀硫酸的浓度偏高,故答案为:偏高;
②定容时,液面超过刻度线后用胶头滴管吸至液面处,导致溶液体积偏大,则浓度偏低,故答案为:偏低;
③有水,没干燥,因定容还需要加水,则对所配溶液的浓度无影响,故答案为:无影响;
Ⅲ.200ml 5mol/lNaOH溶液中含溶质的质量是0.2L×5mol/L×40g/mol=40g,溶液具有均一性,则取出20ml溶液,其溶质的物质的量浓度是5mol/L.将取出的溶液稀释至100ml,由稀释前后溶质的物质的量不变可知,其溶质的物质的量浓度是$\frac{0.02L×5mol/L}{0.1L}$=1mol/L,
故答案为:40g;5mol/L;1 mol/L.
点评 本题考查较综合,涉及实验仪器及实验装置、溶液的配制、物质的量的计算等,综合性较强,注重基础知识的考查,把握实验技能及物质的量的相关计算为解答的关键,题目难度不大.

| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中C(CO)不变
C.v(H2)正=v(H2O)逆 D.C(CO)=C(H2)
E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为C(CO2)为2mol/L,C(H2)为 1.5mol/L,C(CO) 为1mol/L,C(H2O)为 3mol/L,则下一时刻,反应向逆向移动(填“正向”,“逆向”或“不”),依据:浓度商Qc=$\frac{1×3}{2×1.5}$=1>800℃时平衡常数K=0.9.
(主要成分FeS2)为主要原料制备碳酸锰(MnCO3难溶,分解温度较高)的一种工艺流程如下:
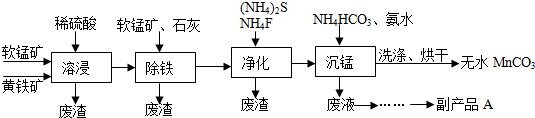
已知:几种金属离子沉淀的pH如下表:
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
(1)为了提高溶浸工序中原料的浸出效率,可以采取的措施有ABC
A.适当升高温度 B.搅拌 C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:
2FeS2+15MnO2+28H+=2Fe3++15Mn2++4SO42ˉ+14H2O
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.
请写出除去Cu2+的离子方程式:Cu2++S2ˉ=CuS↓;
若测得滤液中c(Fˉ)=0.01mol•Lˉ1,则滤液中残留c(Ca2+)=1.5×10-6mol•Lˉ1.
[已知:Ksp(CaF2)=1.5×10ˉ10]
(4)除铁工序中,先加入适量的软锰矿,其作用是使残余Fe2+转化为Fe3+,再加入石灰调节溶液的pH的范围为3.7~5.2.
(5)副产品A的主要成分是(NH4)2SO4.
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球位于蒸馏烧瓶支管口处 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 称量时,将放称量纸或烧杯中的称量物置于托盘天平的左盘,砝码放在托盘天平的右盘 |
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 110 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②计算在80℃时该反应的N2O4的转化率=75%此温度下NO2的体积分数=$\frac{6}{7}$,此时容器内压强与反应起始时的比值为$\frac{7}{4}$.
③反应进行至110s后将反应混合物的温度降低,混合气体的颜色变浅;如果此时加入NO2,则此时容器内颜色变深(填“变浅”、“变深”或“不变”)
④要增大该反应NO2 的体积分数,可采取的措施有(填序号)D
A.增大N2O4的起始浓度 B.通入N2气体
C.使用高效催化剂 D.升高温度.
| A. | 用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液 | |
| B. | 分馏石油时,温度计的末端必须插入液面下 | |
| C. | 用分液漏斗分离环己烷和水的混合液体 | |
| D. | 用浓氨水洗涤做过银镜反应的试管 | |
| E. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止 |