题目内容
【题目】滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
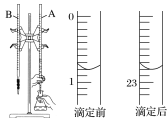
请回答下列问题:
①仪器A的名称是____________。
②盐酸的体积读数:滴定后读数为________mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O32-===2I-+S4O62-)。
①c中指示剂是_______________,判断c中恰好完全反应所依据的现象是___________。
②写出步骤b的离子方程式_____________________。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________(填“偏高”“偏低”或“不变”)。
【答案】酸式滴定管 22.80 淀粉 溶液由蓝色变为无色,且半分钟不褪色 IO3-+5I-+6H+===3I2+3H2O 1.0×10-5 1270/3W 偏高
【解析】
(1)①根据仪器的结构来分析;
②根据滴定管的结构与精确度为0.01mL;
(2)①淀粉遇碘单质变蓝;
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全,根据题意写出方程式;
(3)由IO3-+5I-+6H+=3I2+3H2O、I2+2S2O32-=2I-+S4O62-可知,存在IO3-~6S2O32-,以此计算。
(1)①该滴定管的下端是玻璃活塞,所以仪器的名称为酸式滴定管,
故答案为:酸式滴定管;
②滴定前,滴定管中的液面读数为0.80mL,滴定后,滴定管中的液面读数为22.80mL,
故答案为: 22.80;
(2)①c中加入的指示剂可选用淀粉,恰好完全反应时的现象是溶液由蓝色恰好变为无色,且30s内不恢复,
故答案为:淀粉;溶液由蓝色恰好变为无色,且30s内不恢复;
②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全,根据加入的物质和题意可以写出方程式是IO3-+5I-+6H+=3I2+3H2O
故答案为:IO3-+5I-+6H+=3I2+3H2O;
③加入物质的量浓度为2.0×10-3molL-1的Na2S2O3溶液10.0mL,恰好反应完全,由I2+2S2O32-===2I-+S4O62-),可知碘单质的物质的量是Na2S2O3的一半,即是2.0×10-3molL-1×0.01L=1.0×10-5 ;
故答案为:1.0×10-5 ;
④IO3-~6S2O32-可知,则所测食用精制盐的碘含量是
2.0×10-3mol/L×0.01L×1/6×127g/mol×1000mg÷(w×10-3)= 1270/3W
故答案为:1270/3W
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,使消耗标准液的体积偏大,测的结果偏高,
故答案为:偏高。

【题目】有A、B、C、D、E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______________。
(2)C元素的第一电离能比氧元素的第一电离能_______________ (填“大”或“小”) 。
(3)CA3分子中C原子的杂化类型是_______________。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为____________ (填序号)。
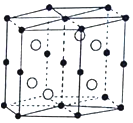
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示,其中D离子的配位数为_______________,若该晶体的密度为a g·cm3,则该晶胞的体积是_____________cm3(写出表达式即可)。