题目内容
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
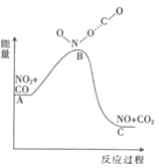
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
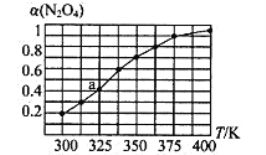
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。

(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
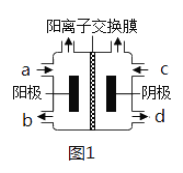
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
【答案】C > 温度升高,α(N2O4)增加,说明平衡右移。该反应为吸热反应,△H>0 115.2 k2×Kp/2 B点D点 d 2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑
2(CH3)4NOH+H2↑+Cl2↑
【解析】
(1)A、A→B能量升高,属于吸热过程,故A错误;
B、反应物的能量高于生成物的能量,此反应为放热反应,则1molNO2和1molCO的键能总和小于1molNO和1molCO2的键能总和,故B错误;
C、反应中C和N的化合价发生变化,则反应属于氧化还原反应,故C正确;
D、根据图像,反应物总能量高于生成物总能量,则1molNO2和1molCO的总能量高于1molNO和1molCO2的总能量,故D错误;
(2)①随着温度的升高,N2O4转化率增大,升高温度平衡向正反应方向进行,根据勒夏特列原理,正反应方向为吸热反应,即△H>0;
②令起始时N2O4物质的量为1mol,N2O4(g)![]() 2NO2(g)
2NO2(g)
起始: 1 0
变化: 0.4 0.8
平衡: 0.6 0.8 其他条件相同,压强之比等于物质的量之比,达到平衡时的压强为108×1.4/1kPa=151.2kPa,NO2的物质的量分数为0.8/(0.6+0.8)=4/7,N2O4的物质的量分数为3/7,根据平衡常数的定义,Kp=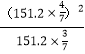 =115.2kPa;
=115.2kPa;
③化学平衡常数Kp=[p(NO2)]2/p(N2O4),利用速率之比等于化学计量数之比, v(N2O4)/v(NO2)=1/2,将公式代入,得出![]() =1/2,得出k1=k2×Kp/2;满足平衡条件,v(NO2)=2v(N2O4),即为平衡点,BD点的压强之比等于其反应速率之比的1:2,所以BD点为平衡点;
=1/2,得出k1=k2×Kp/2;满足平衡条件,v(NO2)=2v(N2O4),即为平衡点,BD点的压强之比等于其反应速率之比的1:2,所以BD点为平衡点;
(4)①以石墨为电极电解四甲基氯化铵制备四甲基氢氧化铵,需要OH-的参加,电解过程中阴极得到电子生成H2,得到OH-,收集到四甲基氢氧化铵的区域是阴极区,即d口;
②根据电解原理,电解过程中生成物为四甲基氢氧化铵、H2和Cl2,电解反应的化学方程式为2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑。
2(CH3)4NOH+H2↑+Cl2↑。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案