题目内容
12.某矿石样品中可能含铁,为确定其成分,进行如下操作:
下列有关说法正确的是( )
| A. | 向溶液乙中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| B. | 向溶液乙中滴加少量氢氧化钠溶液,一定出现红褐色沉淀 | |
| C. | 向溶液甲中滴加KSCN溶液,溶液颜色变红,则原矿石样品中存在Fe3+ | |
| D. | 该矿石一定为赤铁矿 |
分析 A.由于滤液甲中进入了氧化剂氯气,无法判断原样品中是否存在铁离子;
B.由于无法确定矿石中是否含有铁元素,所以滤液乙中加入氢氧化钠溶液不一定出现红褐色;
C.向滤液甲中进入硫氰化钾溶液,溶液变红证明原样品中含有铁离子;
D.该题中信息无法判断该矿石的成分.
解答 解:A.向溶液乙中滴加KSCN溶液,溶液颜色变红,证明滤液乙中存在铁离子,但由于上一步加入了氯气,无法证明原矿石样品中存在Fe3+,故A错误;
B.滤液乙中不一定含有铁离子,所以加入氢氧化钠溶液后不一定会出现红褐色沉淀,故B错误;
C.向溶液甲中滴加KSCN溶液,溶液颜色变红,说明滤液甲中存在铁离子,则原矿石样品中存在Fe3+,故C正确;
D.题中信息和反应流程都无法确定矿石的成分,故D错误;
故选C.
点评 本题考查了亚铁离子、铁离子的检验方法,题目难度不大,注意明确铁离子、亚铁离子的性质,掌握检验亚铁离子和铁离子的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列叙述正确的是( )
| A. | 0.1mol•L-1氨水中,c(OH-)=c(NH4+) | |
| B. | 10 mL 0.02mol•L-1HCl溶液与10 mL 0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
17.分类法在化学学科发展中起到了非常重要的作用,下列分类依据不合理的是( )
| A. | 根据氧化物的性质将氧化物分成酸性氧化物、碱性氧化物和两性氧化物等 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据是否有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据组成元素的种类将纯净物分为单质和化合物 |
4.下列与标准状况下6.72L SO2气体含有氧原子数相同的是( )
| A. | 标准状况下6.72 L CO | B. | 0.3NA个Na2SO3 | ||
| C. | 常温常压下9.6g O2 | D. | 1.806×1023个H2O分子 |
1.下列说法中,正确的是( )
| A. | 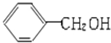 与 与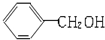 互为同系物 互为同系物 | B. | 乙醇和二甲醚互为同分异构体 | ||
| C. | 乙醇、乙二醇、丙三醇互为同系物 | D. | 可用浓溴水来区分乙醇和苯酚 |
2.根据如图的转化关系(反应条件已略去),判断下列说法正确的是( )

| A. | 反应①中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 反应②属于非氧化还原反应 | |
| C. | 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1 | |
| D. | 根据反应⑤可判断还原性:Al>Mn |
