题目内容
19.一定温度下可逆反应N2(g)+3H2(g)?2NH3(g)达平衡的标准是:(分别用V(正)表示正反应速率,V(逆)表示逆反应速率)( )| A. | 2V(正)(N2)=V(逆)(NH3) | B. | V(正)(N2)=3V(正)(H2) | ||
| C. | 2V(正)(H2)=3V(逆)(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
分析 可逆反应中正逆反应速率相等时该反应达到平衡状态,平衡体系中各物质物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.2V(正)(N2)=V(逆)(NH3)时,反应速率与其计量数之比相等,所以各物质的正逆反应速率相等,则该反应达到平衡状态,故A正确;
B.无论是否达到平衡状态,始终存在V(N2)=3V(H2),所以不能据此判断平衡状态,故B错误;
C.2V(正)(H2)=3V(逆)(NH3),同一物质的正逆反应速率相等,所以反应达到平衡状态,故C正确;
D.N2、H2、NH3的体积比为1:3:2时,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,所以不能据此判断平衡状态,故D错误;
故选AC.
点评 本题考查化学平衡状态的判断,只有反应前后改变的物理量才能作为判断依据,再结合同一物质的正逆反应速率相等判断,题目难度不大.

练习册系列答案
相关题目
9.乙烯和丙烯按1:1(物质的量)聚合时,生成聚合乙丙树脂,该聚合物的结构是( )
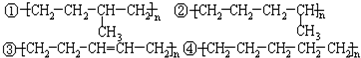
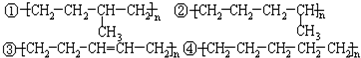
| A. | ①② | B. | ②③ | C. | ①④ | D. | ①③ |
10.下列说法不正确的是( )
| A. | 向海带灰浸取液中滴加硫酸、过氧化氢和淀粉后,溶液变蓝,说明海带中含碘 | |
| B. | 向浓缩海水中通入氯气,再吹入空气,可以将溴从海水中提取出来 | |
| C. | 埋入地下的铁制管道用连接镁的方法加以防护 | |
| D. | 石油的分馏和煤的干馏都属于化学变化 |
14.下列变化中,既属于吸热反应,又属于氧化还原反应的是( )
| A. | 碳酸钙受热分解 | B. | 灼热的木炭与二氧化碳反应 | ||
| C. | 铝粉与盐酸的反应 | D. | 硝酸铵溶于水 |
4.下列与标准状况下6.72L SO2气体含有氧原子数相同的是( )
| A. | 标准状况下6.72 L CO | B. | 0.3NA个Na2SO3 | ||
| C. | 常温常压下9.6g O2 | D. | 1.806×1023个H2O分子 |
8.下列各组物质中,依次属于单质、酸、盐的一组是( )
| A. | 干冰、石灰石、氧化钙 | B. | 液氯、硝酸、纯碱 | ||
| C. | 水、烧碱、食盐 | D. | 氧气、盐酸、熟石灰 |