题目内容
加热N2O5时,发生以下两个反应:N2O5 N2O3 + O2,N2O3
N2O3 + O2,N2O3 N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
 N2O3 + O2,N2O3
N2O3 + O2,N2O3 N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( )
N2O + O2。在1L密闭容器中加热4molN2O5,达到平衡时,c(O2)为4.5mol?L-1,c(N2O3) 为1.62mol?L-1,则c(N2O5) 为( ) | A.1.44mol?L-1 | B.3.48mol?L-1 | C.0.94mol?L-1 | D.1.98mol?L-1 |
C
试题分析:假设发生N2O5
 N2O3 + O2,产生的N2O3和O2的浓度为X,其中发生N2O3
N2O3 + O2,产生的N2O3和O2的浓度为X,其中发生N2O3 N2O + O2改变的浓度为Y。则X-Y=1.62mol/L;X+Y=4.5mol/L解得X=3.06mol/L;Y=1.44mol/L。则达到平衡时c(N2O5)= 4mol/L-3.06mol/L=0.94mol/L.因此选项为C。
N2O + O2改变的浓度为Y。则X-Y=1.62mol/L;X+Y=4.5mol/L解得X=3.06mol/L;Y=1.44mol/L。则达到平衡时c(N2O5)= 4mol/L-3.06mol/L=0.94mol/L.因此选项为C。
练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
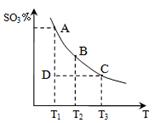
 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”); 2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;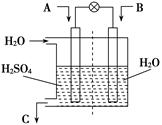
 C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( ) 3C(g)+D(g),以下不能说明已达平衡状态的是
3C(g)+D(g),以下不能说明已达平衡状态的是 2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是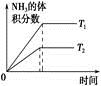


 Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是
Ni(CO)4(g),已知该反应平衡常数与温度的关系下表,下列说法正确的是 C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是  2C(g) ΔH>0。
2C(g) ΔH>0。