题目内容
一定条件下存在反应:A(g)+B(g) C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
 C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是 | A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中A的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1 |
CD
试题分析:在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,反应是从正、逆两个反应方向发生。当反应达到平衡时各组分的含量相同。为同一平衡状态。但是正反应是放热反应,而逆反应为吸热反应,由于反应放出的热量不同,所以反应速率不同。错误。B.容器Ⅲ中由于反应物浓度大,化学平衡正向移动,放热更多。由于温度不同,所以这两个容器的反应的平衡常数不相同。错误。C.由于容器Ⅰ的正反应为放热反应。随着反应的进行,反应的温度升高。而升高温度,化学平衡向逆反应方向移动。因此容器Ⅰ中A的物质的量比容器Ⅱ中的多。正确。D.容器Ⅰ中反应是从正反应方向开始的,容器Ⅱ中是反应是从逆反应方向开始的。由于恒容绝热(与外界没有热量交换),所以A的转化率与容器Ⅱ中C的转化率之和必然小于1。正确。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
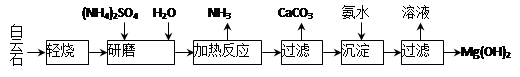
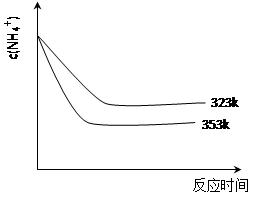
 N2O3 + O2,N2O3
N2O3 + O2,N2O3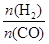 ]:当γ=2时,甲醇的选择性[λ =
]:当γ=2时,甲醇的选择性[λ =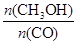 ]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式 。
]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式 。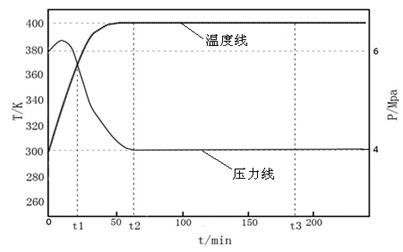
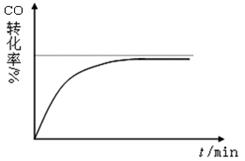
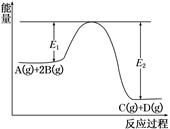
 xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图: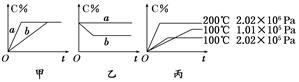
 ?C(g)+D(g)已达到平衡状态
?C(g)+D(g)已达到平衡状态  4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是