题目内容
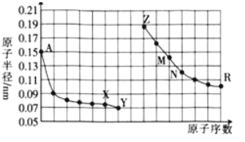
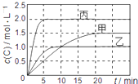
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度 | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.物质A的化学计量数x=2
D.保持甲容器体积不变,向其中通入He气体,达到新平衡后,C的百分含量减小
【答案】B
【解析】
A. 由图可知:5min时 c(C)关系为乙>甲,说明反应速率乙>甲,温度T1<T2;平衡时c(C)关系为乙<甲,说明温度低有利于平衡的正向移动,则正反应为放热反应,A错误;
B. 利用三段式进行分析(x=1,分析过程见C选项)
A(g)+B(g)![]() 2C(g)
2C(g)
起始量 1mol/L 3mol/L 0
变化量 0.5mol/L 0.5mol/L 1mol/L
平衡量 0.5mol/L 2.5mol/L 1mol/L
![]() B正确;
B正确;
C. 比较乙和丙,温度相同,丙中反应物的浓度分别为乙中反应物浓度的2倍;从图中可以看出,平衡时丙中c(C)也为乙中c(C)的2倍,说明压强改变平衡不发生移动,反应前后气体的分子数相等,从而得出x=1,C错误;
D. 保持甲容器体积不变,向其中通入He气体,气体的浓度不变,平衡不发生移动,C的百分含量不变,D错误。
故答案为B。

【题目】某小组同学通过实验研究FeCl3溶液与Cu发生的氧化还原反应,实验记录如下表所示,下列说法错误的是( )
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜有剩余,溶液黄色褪去,变成蓝色加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液中阴离子种类有关
C.实验Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀