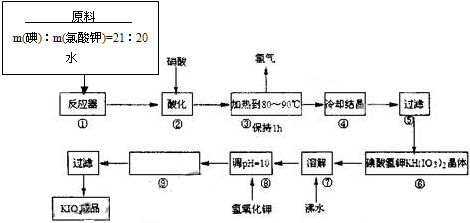
题目内容
8.(1)将pH=10和pH=12的NaOH溶液以1:1的体积比混合,则混合后所得溶液的pH约为11.7.(2)0.2mol/LNaHSO4和0.1mol.LBaCl2溶液按等体积混合后,则溶液的pH等于1.
(3)用pH=4和pH=11的强酸和强碱混合后,使pH=10,则两溶液的体积比为9:2.
分析 (1)25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,两种碱溶液混合,先计算出混合后溶液的c(OH-),再根据溶液的Kw计算出溶液的c(H+),然后根据PH=-lg(c(H+)求PH值;
(2)硫酸氢钠与氯化钡反应生成硫酸钡沉淀、氯化氢、氯化钠,反应过程中氢离子的物质的量不变,等体积混合后氢离子浓度变为原先的一半,然后根据pH=-lgc(H+)计算出混合液的pH;
(3)pH=4的强酸溶液中c(H+)=10-4mol/L,pH=11的强碱溶液中c(OH-)=10-3mol/L,混合液的pH=10,则混合溶液中c(OH-)=10-4mol/L=$\frac{C(O{H}^{-})V碱-C({H}^{+})V酸}{V酸+V碱}$,据此计算酸碱体积之比.
解答 解:(1)25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,pH=12的NaOH溶液中c(OH-)=1×10-2mol/L,混合后c(OH-)=$\frac{1{0}^{-4}+1{0}^{-2}}{2}$mol/L≈$\frac{1{0}^{-2}}{2}$mol/L,则溶液中的c(H+)=$\frac{{K}_{W}}{C(O{H}^{-})}$=$\frac{1{0}^{-14}}{\frac{1{0}^{-2}}{2}}$mol/L=2.0×10-12mol/L,所以PH=12-lg2=11.7,
故答案为:11.7;
(2)0.2mol/LNaHS04和0.1mol/LBaCl2溶液按等体积混合,反应过程中氢离子的物质的量不变,则混合液中氢离子浓度为硫酸氢钠溶液中氢离子浓度的一半,即:c(H+)=$\frac{1}{2}$c(NaHS04)=$\frac{1}{2}$×0.2mol/L=0.1mol/L,混合液的pH=-lgc(H+)=-lg0.1=1,
故答案为:1;
(3)pH=4的强酸溶液中c(H+)=10-4mol/L,pH=11的强碱溶液中c(OH-)=10-3mol/L,混合液的pH=10,即混合后显碱性,故应根据c(OH-)的浓度来计算.
设强酸的体积为aL,强碱的体积为bL,
则有:混合溶液中c(OH-)=10-4mol/L=$\frac{C(O{H}^{-})V碱-C({H}^{+})V酸}{V酸+V碱}$=$\frac{1{0}^{-3}mol/L×bL-1{0}^{-4}mol/L×aL}{(a+b)L}$解得a:b=9:2,故答案为:9:2.
点评 本题考查了溶液pH的简单计算,注意两种碱溶液混合后的溶液氢离子浓度计算,先计算溶液中c(OH-),再计算c(H+),注意硫酸氢钠与氯化钡混合过程中氢离子的物质的量不变,题目难度中等.

| A. | CH3COONa | B. | NaHCO3 | C. | NaCl | D. | NH4Cl |
| A. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3.H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| C. | Cu与浓硝酸反应制备N02:3Cu+8H++2NO${\;}_{3}^{-}$═3Cu2++2NO2↑+4H2O | |
| D. | 向KAl(S04)2溶液中滴加Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO${\;}_{4}^{2-}$+2Ba2++4OH-═AlO${\;}_{2}^{-}$+2BaSO4↓+2H2O |
| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
 已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)═N2O4(g)△H(298K)=-52.7kJ•mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:



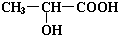 +2Na→
+2Na→ +H2↑
+H2↑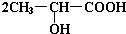 +Na2CO3→
+Na2CO3→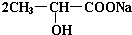 +H2O+CO2↑,
+H2O+CO2↑,
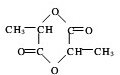
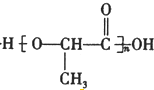
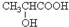 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O. A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:
A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题: