题目内容
3.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.探究二氧化硫的制取和性质都有着非常重要的意义.(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2:
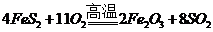
该反应中被氧化的元素是S、Fe(填元素符号).当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为22.4L.
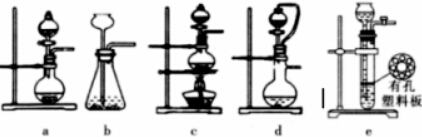
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是a d(填写字母).
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.2%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠26.1g(保留一位小数).
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质.


①能说明二氧化硫具有氧化性的实验现象为a试管中有淡黄色沉淀生成.
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是II(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-.
分析 (1)氧化还原反应中,化合价升高的元素在反应中被氧化,根据电子守恒确定转移电子的量与二氧化硫的量之间的关系;
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,为固体与液体反应不加热装置,能控制反应速度,利用分液漏斗控制液体的加入;
②由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量;设没有变质的亚硫酸钠为100g,根据变质的质量计算出变质后溶液中亚硫酸钠的质量分数,再计算出需要变质后的亚硫酸钠的质量;
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
②氯水中含有氯气,氯水中还含有次氯酸、HCl,氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸.
解答 解:(1)氧化还原反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$8SO2+2Fe2O3中,化合价升高的Fe、S元素在反应中被氧化,该反应生成8mol的二氧化硫,转移电子的物质的量为44mol,所以当该反应转移5.50mol电子时,生成的二氧化硫的物质的量为1mol,在标准状况下的体积为22.4L,
故答案为:S、Fe; 22.4;
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,为固体与液体反应不加热装置,能控制反应速度,利用分液漏斗控制液体的加入,有a、d符合,
故答案为:a、d;
②由硫守恒可得:Na2SO3~SO2,因此需称取亚硫酸钠的质量为:m(Na2SO3)=126g•mol-1×$\frac{3.36L}{22.4L/mol}$=18.9g;
设没有变质的亚硫酸钠为100g,则有25.2g亚硫酸钠被氧化成硫酸钠,25.2g亚硫酸氧化为硫酸钠后质量变为:25.2g×$\frac{142}{126}$=28.4g,则有25.2%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为$\frac{100g-25.2g}{100g-25.2g+28.4g}$×100%≈72.5%,
因此称取变质后样品的质量应为$\frac{18.9g}{72.5%}$≈26.1g,
故答案为:26.1;
(3)①二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,所以能说明二氧化硫具有氧化性的实验现象为a试管中有淡黄色沉淀生成,
故答案为:a试管中有淡黄色沉淀生成;
②氯水中含有氯气,氯水中还含有次氯酸、HCl,氯气和次氯酸具有强氧化性,
方案I:向第一份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,S元素的化合价升高,体现二氧化硫的还原性,则实验设计合理,
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
故答案为:II;Cl2+SO2+2H2O=4H++2Cl-+SO42-.
点评 本题考查二氧化硫的性质,侧重分析与应用计算能力的考查,二氧化硫具有氧化性、还原性、漂白性,注意该实验的目的,能从化合价变化上来分析解答,题目难度中等.

| A. | 3,3-二甲基丁烷 | B. | 2,2-二甲基丁烷 | ||
| C. | 2-乙基丁烷 | D. | 2,3,3-三甲基丁烷 |
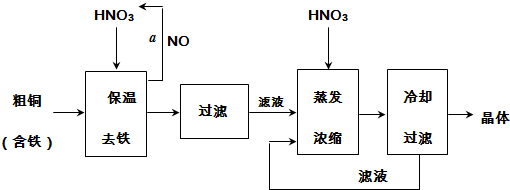
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是4NO+3O2+2H2O=4HNO3.
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7范围.若调节溶液的pH=4,此时,溶液中c (Fe3+)=4.0×10-6mol•L-1.[已知该条件下,Fe(OH)3的KSP=4.0×10-36]
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明)由于Cu2+发生水解:Cu2++2H2O
 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解.(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是Cu2++2e-=Cu.
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| C. | 对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应 | |
| D. | FeCl3+3KSCN?3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动 |
 某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ.
某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ. | t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
(2)该温度下反应的平衡常数K=$\frac{1600}{9}$.
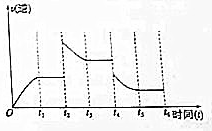
(3)若该反应的逆反应速率与时间的关系如图所示.则:
①t2~t3时平衡向逆(填“正”或“逆”)反应方向移动.
②t4时被改变的外界条件是B(选择一个正确选项)
A升温 B降温 C.降压 D.移去部分反应物 E加入负催化剂.
| A. | 4m mol | B. | 10m mol | C. | $\frac{10m}{3}$mol | D. | $\frac{2m}{3}$mol |
 氮及其化合物在生产、生活中有极其重要的作用.
氮及其化合物在生产、生活中有极其重要的作用.