题目内容
20.下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )| A. | 2HCl+2Na═2NaCl+H2↑ | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
分析 A.发生2HCl+2Na═2NaCl+H2↑,Na作还原剂,HCl作氧化剂;
B.发生2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3没有化合价变化;
C.发生I2+2NaClO3═2NaIO3+Cl2,I2作还原剂,NaClO3作氧化剂;
D.发生4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,一半HCl作还原剂.
解答 解:A.发生2HCl+2Na═2NaCl+H2↑,Na作还原剂,HCl作氧化剂,则氧化剂和还原剂的物质的量之比为1:1,故A不选;
B.发生2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)3没有化合价变化,不属于氧化还原反应,故B不选;
C.发生I2+2NaClO3═2NaIO3+Cl2,I2作还原剂,NaClO3作氧化剂,则氧化剂和还原剂的物质的量之比为2:1,故C不选;
D.发生4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,一半HCl作还原剂,MnO2为氧化剂,则氧化剂和还原剂的物质的量之比为1:2,故D选;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意HCl(浓)的作用,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
10.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
(2)除去反应混合物中的不溶物;
(3)电解混合液MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4;
下列说法不正确的是( )
(1)软锰矿、闪锌矿与硫酸共热:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
(2)除去反应混合物中的不溶物;
(3)电解混合液MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4;
下列说法不正确的是( )
| A. | 步骤(1)中每析出12.8g S沉淀共转移0.4mol电子 | |
| B. | 步骤(1)中ZnS的还原性大于MnSO4的还原性 | |
| C. | 电解时MnO2在阳极处产生 | |
| D. | 硫酸在生产中可循环使用 |
11.下列说法中正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 | |
| C. | 对一个可逆反应来说,吸热反应一方的速率受温度变化的影响总是大于放热反应 | |
| D. | FeCl3+3KSCN?3KCl+Fe(SCN)3 体系中加入KCl固体,平衡向逆反应方向移动 |
12.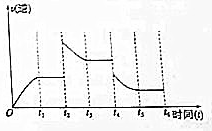 某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ.
某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ.
(1)写出该反应的热化学反应方程式:X(g)+2Y(g)?2Z(g)△H=-300kJ/mol.
(2)该温度下反应的平衡常数K=$\frac{1600}{9}$.
(3)若该反应的逆反应速率与时间的关系如图所示.则:
①t2~t3时平衡向逆(填“正”或“逆”)反应方向移动.
②t4时被改变的外界条件是B(选择一个正确选项)
A升温 B降温 C.降压 D.移去部分反应物 E加入负催化剂.
 某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ.
某温度时,在2L密闭容器中有X、Y、Z三种气态物质,实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ. | t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.60 | 0.20 | 0.80 |
| 14 | 0.60 | 0.20 | 0.80 |
(2)该温度下反应的平衡常数K=$\frac{1600}{9}$.
(3)若该反应的逆反应速率与时间的关系如图所示.则:
①t2~t3时平衡向逆(填“正”或“逆”)反应方向移动.
②t4时被改变的外界条件是B(选择一个正确选项)
A升温 B降温 C.降压 D.移去部分反应物 E加入负催化剂.
9.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的( )
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 光照一段时间氯水,溶液的pH值增大 | |
| C. | 加入少量固体AgNO3,溶液的pH值减小 | |
| D. | 加入少量水,水的电离平衡向右移动 |
14.工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法.下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO.
b.乙烯氧化法制乙醛2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO.
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法,分析可能的原因(从环境、原料来源、能耗等角度分析,任写一点):两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等.
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?乙烯氧化法快.
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法,理由是因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济.
(5)如果某工厂以乙烯为原料,通过3步可以制得聚氯乙烯,请写出合理的反应方程式(无机试剂和溶剂等任选,改过程中不发生取代反应) .
.
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
(1)写出下列化学方程式:
a.乙炔水化法制乙醛CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO.
b.乙烯氧化法制乙醛2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO.
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法,分析可能的原因(从环境、原料来源、能耗等角度分析,任写一点):两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等.
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?乙烯氧化法快.
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法,理由是因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济.
(5)如果某工厂以乙烯为原料,通过3步可以制得聚氯乙烯,请写出合理的反应方程式(无机试剂和溶剂等任选,改过程中不发生取代反应)
 .
.