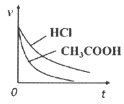
题目内容
【题目】连二亚硫酸钠![]() ,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
,俗称保险粉,易溶于水,常用于印染、纸张漂白等。回答下列问题:
(1)![]() 中S的化合价为______。
中S的化合价为______。
(2)向锌粉的悬浮液中通入![]() ,制备
,制备![]() ,生成
,生成![]()
![]() ,反应中转移的电子数为____mol;向
,反应中转移的电子数为____mol;向![]() 溶液中加入适量
溶液中加入适量![]() ,生成
,生成![]() 并有沉淀产生,该反应的化学方程式为_________
并有沉淀产生,该反应的化学方程式为_________
(3)![]() 电池具有高输出功率的优点。其正极为可吸附
电池具有高输出功率的优点。其正极为可吸附![]() 的多孔碳电极,负极为金属锂,电解液为溶解有
的多孔碳电极,负极为金属锂,电解液为溶解有![]() 的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为
的碳酸丙烯酯-乙腈溶液。电池放电时,正极上发生的电极反应为![]() ,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
,电池总反应式为____________。该电池不可用水替代混合有机溶剂,其原因是_______________。
【答案】+3 2 ![]()
![]()
![]() 与水反应
与水反应
【解析】
(1)根据化合物中所有元素正负化合价的代数和等于0,结合常见的Na为+1价,O为-2价判断S元素的化合价;
(2)根据反应前后Zn元素的化合价的变化判断转移电子的物质的量,根据质量守恒定律书写反应方程式;
(3)负极上是Li失去电子变为Li+,根据闭合回路中电子转移数目相等,结合正极反应式,叠加,可得总反应方程式;Li是比较活泼的金属,可以与水反应产生相应的碱和氢气。
(1)在![]() 中Na为+1价,O为-2价,由于化合物中所有元素正负化合价的代数和等于0,所以S元素化合价为+3价;
中Na为+1价,O为-2价,由于化合物中所有元素正负化合价的代数和等于0,所以S元素化合价为+3价;
(2)向锌粉的悬浮液中通入SO2,制备ZnS2O4,反应前Zn为单质中的0价,反应后变为ZnS2O4中的+2价,所以每生成![]() ZnS2O4,反应中转移的电子数为2mol;向ZnS2O4溶液中加入适量Na2CO3,生成Na2S2O4并有沉淀产生,生成的沉淀为ZnCO3,则该反应的化学方程式为Na2CO3+ ZnS2O4=Na2S2O4+ZnCO3↓;
ZnS2O4,反应中转移的电子数为2mol;向ZnS2O4溶液中加入适量Na2CO3,生成Na2S2O4并有沉淀产生,生成的沉淀为ZnCO3,则该反应的化学方程式为Na2CO3+ ZnS2O4=Na2S2O4+ZnCO3↓;
(3)![]() 电池具有高输出功率的优点,负极是Li失去电子,电极反应式为Li-e-=Li+,电池放电时,正极上发生的电极反应为
电池具有高输出功率的优点,负极是Li失去电子,电极反应式为Li-e-=Li+,电池放电时,正极上发生的电极反应为![]() ,根据闭合回路中电子转移数目相等,将两个电极反应式叠加,可得电池总反应式为
,根据闭合回路中电子转移数目相等,将两个电极反应式叠加,可得电池总反应式为![]() 。锂是碱金属,比较活泼,可以与水发生反应生成LiOH和H2,所以该电池不可用水替代。
。锂是碱金属,比较活泼,可以与水发生反应生成LiOH和H2,所以该电池不可用水替代。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为 |
方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s);△H = -169kJ·mol-1
O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+![]() O2(g)=CO(g);△H = -110.5kJ·mol-1
O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+![]() O2(g)=CuO(s);△H = -157kJ·mol-1
O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是:____________。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:

该离子交换膜为__________离子交换膜(填“阴”或“阳”),该电池的阳极反应式为___________,钛极附近的pH值______(填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为________。