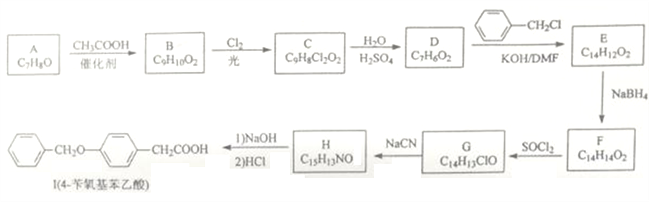
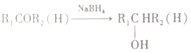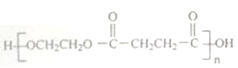题目内容
【题目】在氧化还原反应KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O中,当生成0.5 mol Cl2时,氧化产物和还原产物的物质的量之比为( )
A.5:1B.3:1C.1:3D.1:5
【答案】A
【解析】
同种元素发生氧化还原反应时化合价变化要遵循“只靠近不交叉”的原则即“价态归中”。由于该反应属于归中反应,反应机理为:KClO3中Cl得到5个电子转化为Cl2(被还原),同样的HCl中的Cl失去一个电子转化为Cl2(被氧化),反应中氧化产物和还原产物均为Cl2,且氧化产物和还原产物的物质的量之比等于氧化剂得电子数和还原剂失去电子数之比,即5∶1。
答案选A。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H2= -28.5kJ/mol
2Fe(s)+3CO2(g) H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) H3= akJ/mol ,
则a=__________kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为_______。
②下列情况标志反应达到平衡状态的是________(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
【题目】下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 证明海带中含有碘元素 | 将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝 |
D | 验证CH3COONa 溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
A. A B. B C. C D. D