题目内容
20.下列叙述中,不能用平衡移动原理解释的是( )| A. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释.
解答 解:A.存在平衡2NO2(g)?N2O4(g),增大压强,混合气体的浓度增大,平衡体系颜色变深,该反应正反应为体积减小的反应,增大压强平衡正反应移动,二氧化氮的浓度又降低,颜色又变浅,由于移动的目的是减弱变化,而不是消除,故颜色仍比原来的颜色深,所以可以用平衡移动原理解释,故A不选;
B.存在平衡2SO2+O2(g)?2SO3(g),正反应为气体体积减小的反应,增大压强,平衡向正反应移动,有利于合成SO3,能用平衡移动原理解释,故B不选;
C.存在平衡H2+I2(g)?2HI(g),该反应前后气体的体积不变,增大压强,平衡不移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,不能用平衡移动原理解释,故C选;
D.对氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O?HCl+HClO向右移动,能用平衡移动原理解释,故D不选;
故选C.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
10.常温下,下列溶液中的离子浓度关系一定正确的是( )
| A. | PH=11的Na2SO3溶液中,水的电离c( H+)=1.0×10-11mol/L | |
| B. | PH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c( OH-)=1.0×10-6mol/L | |
| C. | PH=4的NaHC2O4溶液中存在:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-) | |
| D. | PH=2的硝酸与PH=12的氨水等体积混合c( NO3-)>c( NH4+)>c( H+)>c( OH-) |
11.下列除去杂质(括号内为杂质)的方法中,正确的是( )
| A. | NO(NO2):通过装有水的洗气装置 | |
| B. | Cu粉(铁粉):加足量稀硝酸,过滤 | |
| C. | NH3(H2O):通过装有浓硫酸的洗气装置 | |
| D. | KCl(CaCl2):加适量Na2CO3溶液,过滤 |
15.一位患者镶了两颗假牙,其中一颗是黄金的,另一颗是不锈钢的.自镶上假牙后,他时感头疼,心情烦躁,多次治疗未见好转.如果你是医生,下列方法不能治疗其疾病的是( )
| A. | 将两颗假牙都做成黄金的 | B. | 将两颗假牙都做成不锈钢的 | ||
| C. | 将金假牙改为铝质假牙 | D. | 将两颗假牙都做成特殊树脂的 |
5.反应A(g)+3B(g)?2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
| A. | υ(D)=0.40 mol•L-1•s-1 | B. | υ(C)=0.50 mol•L-1•s-1 | ||
| C. | υ(A)=0.30 mol•L-1•s-1 | D. | υ(B)=0.60 mol•L-1•s-1 |
12.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol•L-1 FeCl2溶液,实验记录如表(a、b、c代表电压值):
(1)用KSCN溶液检验出溶液中含Fe3+,看到的现象是溶液变红.
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
①NaCl溶液的浓度应是0.2 mol•L-1.
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
9.“酸化”是实验中经常采用的方法,下列酸化过程正确的是( )
| A. | 提高高锰酸钾的氧化能力,用盐酸酸化 | |
| B. | 抑制Fe2+的水解,用稀硝酸酸化 | |
| C. | 检验某氯代烷烃中含氯元素,加碱溶液加热后用稀硝酸酸化,再加硝酸银溶液检验 | |
| D. | 确认某溶液中含有SO42-时,先加入盐酸酸化,再加氯化钡溶液检验 |
10.COCl2分子的结构式为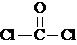 ,COCl2分子内含有( )
,COCl2分子内含有( )
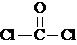 ,COCl2分子内含有( )
,COCl2分子内含有( )| A. | 4个σ键 | B. | 2个σ键、2个π键 | C. | 2个σ键、1个π键 | D. | 3个σ键、1个π键 |