题目内容
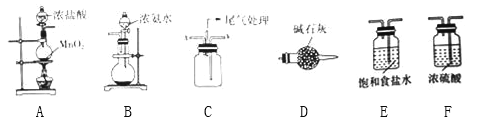
【题目】把下列物质分别加入盛水的锥形瓶内,立即塞紧带 U形管的塞子。已知 U 形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列( )物质后,发生如图所示变化。
①NH4NO3晶体;②浓H2SO4;③NaOH粉末;④NaCl晶体;⑤Na2O2固体;⑥生石灰
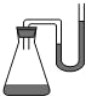
A.①②④⑤B.①②③C.③④⑤D.②③⑤⑥
【答案】D
【解析】
根据U形管中现象的实质是锥形瓶内的气压高于大气压,锥形瓶内气压增大的原因,可能是化学反应生成了气体,也可能是物质溶解或化学反应放出热量,还可能是既生成气体又放出热量,据此分析来解答。
①硝酸铵晶体溶于水吸收热量,锥形瓶内的气体压强减小,①错误;
②浓硫酸溶于水放热,使锥形瓶内的气体压强增大,②正确;
③NaOH粉末溶于水放热,使锥形瓶内的气体压强增大,③正确;
④氯化钠与水不反应,锥形瓶中气体压强几乎不变,④错误;
⑤Na2O2与H2O反应2Na2O2+2H2O=4NaOH+O2↑,生成O2并放出热量,使锥形瓶内的气体压强增大,⑤正确;
⑥生石灰与H2O反应CaO+H2O=Ca(OH)2,放出热量使锥形瓶内的气体压强增大,⑥正确;
综上所述可知:说法正确的是②③⑤⑥;
故合理选项是D。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。