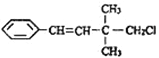
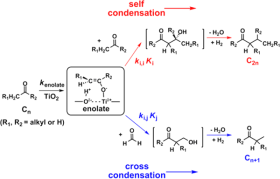
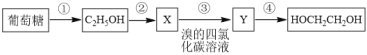题目内容
【题目】实验室用乙醇制取乙烯的装置如下图,回答下列问题。
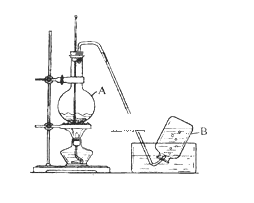
(1)仪器A的名称是__________ ;A中加入沸石的目的是 __________;在烧杯中配制A中溶液的方法是__________ ;在反应中浓硫酸的作用是__________;A中发生反应的化学方程式是 __________ 。
(2)A中产生的气体除乙烯外,还可能混有少量 __________(填化学式)
(3)用乙烯制聚乙烯的化学方程式为 __________
【答案】圆底烧瓶 防暴沸 将3体积浓硫酸延玻璃棒缓缓地注入1体积乙醇中,并不断搅拌冷却 催化剂和脱水剂 CH3CH2OH![]() H2O + CH2=CH2↑ CO2、SO2
H2O + CH2=CH2↑ CO2、SO2 ![]()
【解析】
(1)此实验中用到仪器为圆底烧瓶和集气瓶、酒精灯等;沸石的作用是防止溶液局部过热暴沸,依据浓硫酸稀释放热回答,浓硫酸在乙醇制取乙烯实验中充当催化剂和脱水剂,依据原理书写化学反应液方程式;
(2)乙醇中含有C元素,加热条件下,浓硫酸能够与C反应,据此分析解答;
(3)乙烯发生加聚反应生成聚乙烯。
(1)仪器A为圆底烧瓶,加入沸石是防止溶液局部过热暴沸,由于浓硫酸溶于乙醇放出大量的热,且浓硫酸密度大于乙醇,故应将浓硫酸沿烧杯器壁缓慢的注入乙醇中,并不断搅拌,实验室利用乙醇能发生消去反应制乙烯:CH3-CH2-OH![]() CH2=CH2↑+H2O,浓硫酸作催化剂、脱水剂,故答案为:圆底烧瓶;防暴沸;将3体积浓硫酸延玻璃棒缓缓地注入1体积乙醇中,并不断搅拌冷却;催化剂、脱水剂;CH3-CH2-OH
CH2=CH2↑+H2O,浓硫酸作催化剂、脱水剂,故答案为:圆底烧瓶;防暴沸;将3体积浓硫酸延玻璃棒缓缓地注入1体积乙醇中,并不断搅拌冷却;催化剂、脱水剂;CH3-CH2-OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
(2)C与浓硫酸加热生成二氧化碳和二氧化硫,化学式分别为:CO2、SO2,故答案为:CO2、SO2;
(3)乙烯发生加聚反应生成聚乙烯,化学反应方程式为:![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
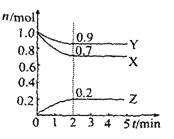
阅读快车系列答案【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
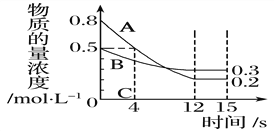
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
【题目】一种用富锰渣(主要成分为MnCO3以及Fe、Ba及Al的盐类或氧化物及少量重金属盐等)制备MnCl2的工艺流程如下:

回答下列问题:
(1)“溶浸”时,为了提高锰的浸取率,列举2条有效的措施:___________,写出该步中MnCO3参与反应的化学方程式:__________。
(2)“氧化”时,主要反应的离子方程式为______________。
(3)滤渣2的主要成分为______(填化学式);简述产生该滤渣的原理:______。
(4)已知部分重金属硫化物的溶度积如表:
硫化物 | MnS | PbS | CuS | NiS |
Ksp | 1.32×10-10 | 1.32×10-27 | 1.32×10-35 | 2.82×10-20 |
①“除重金属”时,溶液的pH调到4.5~6.0,pH不宜过低的原因是_______。
②若表中四种金属离子浓度相同,滴入Na2S溶液时首先被沉淀的离子是_______,反应MnS(s)+Cu2+(aq)![]() CuS(s)+Mn2+(aq)的平衡常数K=______。
CuS(s)+Mn2+(aq)的平衡常数K=______。