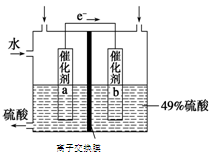
题目内容
在2A+B 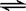 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
B
解析试题分析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值。所以根据反应的方程式可知,如果都要物质C表示反应速率,则分别是0.75 mol/(L·s)、0.9mol/(L·s)、0.8 mol/(L·s)、0.75mol/(L·s),所以答案选B。
考点:考查反应速率快慢的判断
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题还需要注意的是在进行反应速率的转换时,还要注意单位的统一。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl 的浓度。影响反应速率的因素是
的浓度。影响反应速率的因素是 
| A.①④ | B.③④ |
| C.①②③ | D.②③ |
过量的铁粉与100 mL 0.1 mol/L的稀盐酸反应,反应速率太快。为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 1 mol/L的盐酸
| A.①⑥⑦ | B.①④⑤ | C.③⑦⑧ | D.③⑥⑦⑧ |
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )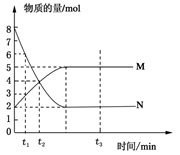
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是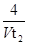 mol/(L?min) mol/(L?min) |
在一个真空固定体积的密闭容器内,充入10molN2和30molH2,发生合成氨反应:N2+3H2 2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
| A.15mol 25% | B.20mol 50% | C.20mol 75% | D.40mol 80% |
实验室用铜与稀硝酸制取NO时,为加快反应速率可采取的措施是
| A.增加铜的用量 | B.增大压强 |
| C.隔绝空气加热 | D.增大硝酸的浓度 |
 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)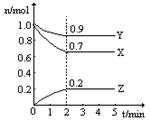
 H2+I2
H2+I2