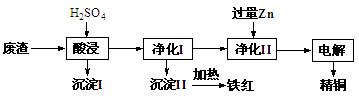
题目内容
(8分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式 。
(2)反应开始至2min,以气体Z表示的平均反应速率为 。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的 倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时_______(填“增大”“减小”或“相等”)。
(8分)(1)3X+Y  2Z(3分) (2)0.05mol.(L.min)-1 (2分) (3)0.9 (2分) 增大(1分)
2Z(3分) (2)0.05mol.(L.min)-1 (2分) (3)0.9 (2分) 增大(1分)
解析试题分析:(1)X和Y的物质的量减小,故X和Y是反应物,Z是生成物,转化量之比等于系数之比,当2分钟时,X减少了0.1mol,Y减少了0.3mol,Z增加了0.2mol,故系数之比为1:3:2,故方程式为:3X+Y  2Z;(2)2分钟时,物质的量增加了0.2mol,浓度变化量为0.1mol/L,除以时间2分钟,即得该时间内的平均反应速率;(3)①体积不变的情况下,容器内的压强之比等于气体的物质的量之比,开始时容器内气体的总物质的量为X:1mol、Y:1mol,共2mol,2分钟后:X:0.9mol、Y:0.7mol、Z:0.2mol,共1.8mol,故压强之比是1.8:2=0.9;②气体总质量不变,总物质的量减小,故平均相对分子质量增加。
2Z;(2)2分钟时,物质的量增加了0.2mol,浓度变化量为0.1mol/L,除以时间2分钟,即得该时间内的平均反应速率;(3)①体积不变的情况下,容器内的压强之比等于气体的物质的量之比,开始时容器内气体的总物质的量为X:1mol、Y:1mol,共2mol,2分钟后:X:0.9mol、Y:0.7mol、Z:0.2mol,共1.8mol,故压强之比是1.8:2=0.9;②气体总质量不变,总物质的量减小,故平均相对分子质量增加。
考点:化学方程式的判断、化学反应速率的计算、平均相对分子质量的判断等知识。

 阅读快车系列答案
阅读快车系列答案过量的铁粉与100 mL 0.1 mol/L的稀盐酸反应,反应速率太快。为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 1 mol/L的盐酸
| A.①⑥⑦ | B.①④⑤ | C.③⑦⑧ | D.③⑥⑦⑧ |
(8分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正)= v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)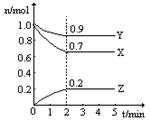
 2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求: H2+I2
H2+I2